
- •Інструкція з безпеки для кабінету (лабораторії) хімії
- •Загальні положення
- •3 Вимоги безпеки під час виконання роботи
- •4. Вимоги безпеки після закінчення роботи
- •5. Вимоги безпеки в екстремальних ситуаціях
- •Лабораторна робота №1
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота № 2
- •Хід роботи.
- •Контрольні запитання.
- •Лабораторна робота №3
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота № 4
- •Хід роботи
- •Контрольні запитання
- •Лабораторна робота № 5
- •Хід роботи
- •2.1. Окислення мурашиного альдегіду купрум гідроксидом
- •2.2. Окислення мурашиного альдегіду аргентум нітратом
- •Контрольні запитання.
- •Лабораторна робота № 6
- •Хід роботи
- •Лабораторна робота №7
- •Хід роботи
- •1. Вивчення властивостей глюкози.
- •1.1.Реакції глюкози, як багатоатомного спирту
- •1.2. Реакції глюкози, як альдегіду
- •3.1. Доведення мономерного складу цукрози
- •Контрольні запитання.
- •Лабораторна робота №8
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота №9
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота №10
- •Хід роботи
- •Література
Хід роботи
Дослід 1. Дослідження хімічних властивостей алюмінію
Взаємодія з кислотами
В пробірку налийте 1 мл розчину хлоридної кислоти та додайте кусочок алюмінію. Що спостерігаєте ? Запишіть рівняння реакції та висновки.
Взаємодія з лугами
В пробірку налийте 1 мл розчину натрій гідроксиду та додайте кусочок алюмінію. Обережно нагрійте. Що спостерігаєте ? Запишіть рівняння реакції та висновки.
Взаємодія з солями
В пробірку налийте 1 мл розчину сульфату міді та додайте кусочок алюмінію. Що спостерігаєте ? Запишіть рівняння реакції та висновки.
Дослід 2. Добування гідроксиду алюмінію.
В пробірку налийте 2 мл розчину солі алюміній хлориду 3 мл розчину натрій гідроксиду. Що спостерігаєте ? Запишіть рівняння реакції та висновки.
Дослід 3.Дослідження амфотерного характеру алюміній гідроксиду.
3.1. Взаємодія з кислотами
Налийте в пробірку 1 мл розчину хлоридної кислоти , додайте невелику кількість алюміній гідроксиду, добутого в досліді 2. Що спостерігаєте? Запишіть рівняння реакції та висновки.
3.2. Взаємодія з основами
Налийте в пробірку 1 мл розчину натрій гідроксиду , додайте невелику кількість алюміній гідроксиду, добутого в досліді 2. Що спостерігаєте? Запишіть рівняння реакції та висновки.
Контрольні запитання.
1. Які хімічні властивості має алюміній ?
2. Що таке амфотерність?
3. Які йони утворюються при дисоціації алюміній гідроксиду?
4. Як довести , що алюміній гідроксид має амфотерні властивості?
5.Напишіть рівняння реакцій , що лежать в основі схеми:
Al →Al 2O3 →AlCl3→Al(OH)3
Al →Al2 (SO4) 3→ Al(OH)3 →Al( NO3)3
Al → AlCl3 → Al(OH)3 → Al2 (SO4) 3
Al→ AlBr3 → Al(OH)3 → AlCl3
Де можливо напишіть повні та скорочені йонні рівняння реакцій.
Лабораторна робота № 4
Тема. Вивчення властивостей одно – та багатоатомних спиртів.
Мета: набути навиків проведення хімічних реакцій між кисневмісними речовинами, дослідити розчинність спиртів, практично здійснити окиснення спирту, якісну реакцію на багатоатомні спирти.
Прилади та реактиви: спирт етиловий (С2Н5ОН),спирт бутиловий (С4Н9ОН) гліцерин (С3Н5 (ОН)3), розчин солі купрум сульфату(СuSO4 ), натрій (Na), розчин лугу (NaOH), мідна дротинка(Cu), фенолфталеїн, штатів з пробірками, тримачі.
Спирти — це органічні сполуки, у молекулах яких містяться одна або кілька функціональних гідроксильних груп, сполучених з вуглеводневим радикалом.
Гомологічний ряд насичених одноатомних спиртів
СН3ОН — метанол (метиловий) |
С6Н13ОН — гексанол (гексиловий) |
С2Н5ОН — етанол (етиловий) |
С7Н15ОН — гептанол (гептиловий) |
С3Н7ОН — пропанол (пропіловий) |
С8Н17ОН — октанол (октиловий) |
С4Н9ОН — бутанол (бутиловий) |
С9Н19ОН — нонанол (ноніловий) |
С5Н11ОН — пентанол (аміловий) |
С10Н21ОН — деканол |
до С12 — спирти рідини, а далі — тверді речовини
Метанол— дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть.
Етанол— наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм.
Молекули багатоатомних спиртів містять у своєму складі дві чи більше гідроксильних груп. Так, у двохатомному спирті дві гідроксильні групи, у трьохатомному — три.
Найпростішим представником таких спиртів є етиленгліколь:
НО-СН2-СН2-ОН
Я
СН2-
СН- СН2
│ │ │
ОН ОН ОН
В
СН2-
СН- СН СН- СН2
│ │ │ │ │
ОН ОН ОН ОН
ОН
сорбіт
СН2-
СН- СН СН- СН-СН2
│ │ │ │ │ │
ОН ОН ОН ОН
ОН ОН
Хімічні властивості.

Як речовини, що мають гідроксильні групи, багатоатомні спирти за хімічними властивостями подібні до одноатомних спиртів. Наприклад, натрій витісняє з них водень: СН2ОН +2Na СН2 – ONa +Н2
│ → │
СН2ОН СН2–ONa При дії галогеноводневих кислот на спирти заміщується гідроксильна група :
СН2ОН - СН2ОН + НСІ → СН2 ОН - СН2СІ + Н2О
Але багатоатомні спирти мають і свої особливості.
Якщо в пробірку з розчином лугу добавити кілька краплин розчин мідного купоросу й до гідроксиду міді Си(ОН)2, що утворюється, влити гліцерину, то матимемо прозорий розчин гліцерату міді яскраво-синього кольору
( утворена речовина має складну
будову, тому її формула не наводиться).
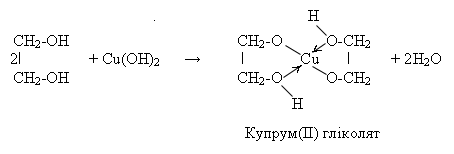
Утворення яскраво - синього розчину під час взаємодії з гідроксидом міді (II) - характерна реакція багатоатомних спиртів.
