
- •Інструкція з безпеки для кабінету (лабораторії) хімії
- •Загальні положення
- •3 Вимоги безпеки під час виконання роботи
- •4. Вимоги безпеки після закінчення роботи
- •5. Вимоги безпеки в екстремальних ситуаціях
- •Лабораторна робота №1
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота № 2
- •Хід роботи.
- •Контрольні запитання.
- •Лабораторна робота №3
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота № 4
- •Хід роботи
- •Контрольні запитання
- •Лабораторна робота № 5
- •Хід роботи
- •2.1. Окислення мурашиного альдегіду купрум гідроксидом
- •2.2. Окислення мурашиного альдегіду аргентум нітратом
- •Контрольні запитання.
- •Лабораторна робота № 6
- •Хід роботи
- •Лабораторна робота №7
- •Хід роботи
- •1. Вивчення властивостей глюкози.
- •1.1.Реакції глюкози, як багатоатомного спирту
- •1.2. Реакції глюкози, як альдегіду
- •3.1. Доведення мономерного складу цукрози
- •Контрольні запитання.
- •Лабораторна робота №8
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота №9
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота №10
- •Хід роботи
- •Література
Хід роботи
Дослід 1. Випробовування спиртів індикатором
В пробірку налийте Імл етилового спирту і додайте 1-2 краплі фенолфталеїну. Запишіть спостереження, зробіть висновки .
Дослід 2 . Дослідженнярозчинності спиртів
В дві пробірки налийте по 1 мл етилового і бутилового спиртів долийте до них ріні кількості води. Запишіть спостереження, зробіть висновки .
Дослід 3.Взаємодія спиртів з активними металами
Закріпіть пробірку в тримачі. Налийте 1-1,5 мл етилового спирту, додайте кусочок натрію (попередньо промокніть фільтрувальним папером гас). Додайте 1-2 краплі фенолфталеїну. Зробіть висновок про реакцію середовища отриманого розчину. Запишіть спостереження та відповідні рівняння реакцій.
Дослід 4. Окислення спиртів
Закріпіть пробірку в тримачі. Налийте 1 мл етилового спирту, Мідну дротинку прожарте на полум'ї для отримання купрум(П) оксиду і занурте її в спирт. Запишіть спостереження, рівняння реакції, висновки .
Дослід 5. Якісна реакція на багатоатомні спирти
В пробірку налийте 1-1,5 мл розчину гліцерину, додайте купрум(І1) гідроксиду, добутого таким чином: до розведеного розчину купрум сульфату долити надлишок натрій гідроксиду.Злити надлишок рідини з купрум гідроксиду до осаду, що залишився, додати 2-3 мл води і збовтати. Як змінилося забарвлення? Запишіть спостереження, рівняння реакції, та висновки .
Дослід 6. Виявлення багатоатомного спирту.
Вам видано дві пронумеровані прбірки №1 і №2. Виконайте необхідний дослід, щоб виявити, в якій з прбірок знаходиться багатоатомний спирт.
Контрольні запитання
Що таке спирти ? Як вони класифікуються?
Як утворюються назви спиртів за номенклатурою ЮПАК та раціональною ?
Які хімічні властивості одноатомних спиртів ви знаєте?
Як залежить розчинність спиртів від молекулярної маси ?
Як виявитибагатоатомний спирт серед інших спиртів?
Виконати перетворення: Метан→ хлорметан→ етан→ етилен→ етанол→ етилят натрію
Лабораторна робота № 5
Тема . Добування альдегідів та вивчення їх властивостей.
Мета: закріпити навики проведення хімічних реакцій між кисневмісними речовинами, практично здійснити окиснення спирту, якісні реакції на альдегіди.
Прилади та реактиви: спирт етиловий (С2Н5ОН), розчин мурашиного альдегіду (НСНО), розчини солей: купрум сульфату(СuSO4 ) аргентум нітрату(AgNO3), розчин лугу(NaOH), нашатирний спирт (NH4OH) мідна дротинка (Cu), штатів з пробірками, тримачі.
Слово "альдегід" буквально означає "спирт, позбавлений водню" (від лат. alcohol dehydrogenatus), тобто окислений спирт.
Карбонільні
сполуки містять в молекулі карбонільну
групу![]() Карбонільні сполуки діляться на альдегіди
и кетони.
Карбонільні сполуки діляться на альдегіди
и кетони.
Альдегіди (алканалі) – це похідні вуглеводнів, що містять карбонільну функціональну групу на початку , або в кінці вуглеводневого ланцюга.
В молекулах альдегідів карбонільна група сполучена з вуглеводородним радикалом і атомом водню (або двома атомами водню), тобто спільна формула цих сполук:
![]()
Назви альдегідів по замісній номенклатурі в співвідношенні з правилами іЮПАК виводять з назви відповідного вуглеводню з додаванням закінчення -аль. Перед корнем назви записують бокові замісники з вказівкою їх положення їх числа. Нумерація атомів вуглецю починається з вуглеводного атома карбонільної групи. Приклади:
Формула |
Тривіальне назва |
Наукова назва |
Н С = О │ Н |
Мурашиний Формальдегід |
Метаналь |
СН3 С = О │ Н |
Оцтовий Ацетальдегід |
Етаналь |
СН3 СН2 С = О │ Н |
Пропіоновий |
Пропаналь |
СН3СН2 СН2 С = О │ Н |
Масляний
|
Бутаналь
|
СН3 (СН2) 3 С = О │ Н |
Валеріановим
|
Пентаналь |
СН3 (СН2) 4 С = О │ Н |
Капроновий
|
Гексаналь |
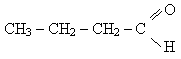
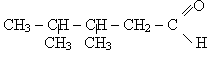
бутаналь 3,4-диметилпентаналь
Физичні властивості: Перший член гомологічного ряду деяких альдегідів НСНО - безбарвний газ, декілька наступних альдегідів - рідини. Вищі альдегіди - тверді речовини. Карбонільна група обслуговує високу реакційну здатність альдегідів. Температура кипіння альдегідів підвищується зі збільшенням молекулярної масы. Кипять вони при більш низькій температурі, ніж відповідні спирти, наприклад пропіоновий альдегід при 48,8 оС, а пропіловый спирт - при 97,8 оС. Густина альдегідів меньша за одиницю. Мурашиний та оцтовий альдегіди добре розчинюються у воді, наступні - гірше. Нищі альдегіди мають різкий, неприємний запах, деякі вищі - приємний запах.
Хімічні властивості. Присутність карбонільної групи визначає велику реакційну здатність альдегідів. Подвійний звязок між киснем і вуглеводнем в групі С = О на відміну від звичайної, подвійний вуглевод-вуглеводного звязку сильно поляризована, так як кисень має значно більшу електронегативність, ніж водень, и електронна густина p-звязку зміщується до кисню:
![]()
Окиснення альдегідів оксидом срібла в аміачному розчині (реакція "срібного дзеркала"). При нагріванні оксид срібла окиснює альдегід і сам відновлюється до чистого срібла:
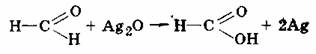
Відновленене срібло, покриваючи стінки посудини тонким шаром, утворює срібне дзеркало.
Окиснення альдегідів гідроксидом міді (II). Свіжоприготовлений блакитний осад гідроксилу міді (II), окиснюючи альдегід, при нагріванні до цегляно-червоного осаду оксиду міді (I):
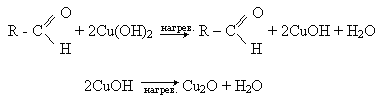
Часто для проведення цієї реакції використовують темно-синю рідину Фелінга - суміш розчинів сульфату міді (II) зі лужним розчином сегнетової солі (калієво-натрієва сіль винної кислоти КООН - СНОН - СНОН - СООNa). При нагріванні з альдегідом синій колір реактиву зникає і випадає в осад оксид міді (II).
Реакції приєднання. Альдегіди легко приєднують циановодень HCN і гідросульфіт натрію NaHSO3:
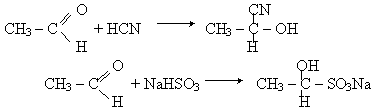
Продукти приєднання NaHSO3 - кристалічні речовини,що розчинюються в воді. При нагріванні з кислотами вони розпадаються з утворенням вихідного альдегіда. Тому остання реакція застосовується для очистки альдегідів.
В присутності нікелевих або платинових каталізаторів альдегіди приєднують водень і відтворюються до первинних спиртів, наприклад:
![]()
Приєднуючи спирти, альдегіди утворюють сполуки, які називаються ацетали. Реакція протікає в присутності кислот:
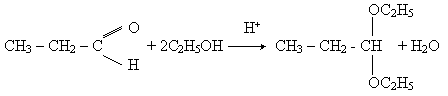
Ацеталі являють собою прості ефіри двохатомного спирту. Вони легко гидролізуються з утворенням вихідних речовин.
Реакція полімеризації і конденсації. Ці реакції характерні для альдегідів і обумовлені реакційною здатністю карбонільної групи. Процеси полімеризації:
![]()
Всі молекули альдегіду можуть сполучатися один з одним в присутності лугу з утворенням сполуки з більш довгим водневим ланцюгом, що містить альдегідну і гідроксильну групи:
Заміщення кисню карбонільної групи. Атом кисню в молекулі альдегіда може бути заміщений на галоген при диї галогенідів фосфора PCl5 или PBr5, например:
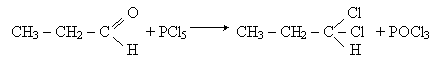
Взаємодія з галогенами. Як вже відзначалось, атом водню при другому атомі вуглегідрогенного ланцюга альдегідів володіє підвищеною рухливістю. При взаємодії альдегідів з хлором або бромом цей гідрогенний атом легко заміщується на галоген, наприклад:
![]()
Отримання.1. Альдегіди виходять при окисленні або каталітичному дегідруванні (відщеплення гідрогену) первинних спиртів:
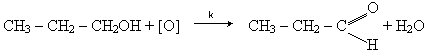
Каталітичне дегідрування спиртів відбувається в присутності металічної міді:
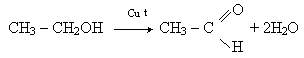
СН3СH2OH + CuO → CH3CHO + Cu+H2O
2. Альдегіди утворюються при взаємодії алкінів з водою
СН≡СН + НОН → CH3CHO
