
- •Самостоятельная работа №2. Химическая термодинамика
- •Определите количество теплоты, которое выделяется (поглощается) при взаимодействии вещества so2 объемом 100м3.
- •Определите область температур, в которой возможно самопроизвольное протекание реакции в прямом направлении при стандартных состояниях всех веществ.
- •Задание 2.
- •Задание 3.
- •3.2. Используя значения Кр при разных температурах, определите термодинамические характеристики реакции (∆rH0т, ∆rS0т ∆rG0т). Какие допущения Вы сделали? Значения температуры выберите сами.
- •3.3. Рассчитайте значения Кр и Кс при температурах т1 и т2 и проанализируйте полученные значения.
- •3.4. Объясните влияние температуры и общего давления на равновесие Вашей реакции и величину константы равновесия.
Задание 2.
В этом задании предлагаются разные задачи для разных вариантов, например, для вариантов 1-15 необходимо определить термодинамические функции для образования вещества, не используя табличные данные.
По данным термохимическим уравнениям рассчитайте при Т = 298 К стандартные энтальпию, энтропию и энергию Гиббса образования вещества А.
Таблица 2. Исходные данные варианта.
Уравнения |
rH0298, кДж |
rS0298, Дж/К |
rG0298, кДж |
Вещество А |
а)Zrт +ZrCl4г = 2ZrCl2г |
+215 |
+208 |
+153 |
ZrCl2 |
б) Zrт +2Cl2г = ZrCl4г |
-867 |
-116 |
-832 |
|
Решение:
Задание основано на том, что с уравнениями химических реакций можно производить любые математические действия. Те же самые операции производят и со значениями термодинамических функций.
Сложим левую и правую части уравнений (а) и (б):
Zrт + ZrCl4г + Zrт + 2Cl2г = 2ZrCl2г + ZrCl4г
Сократим на одинаковые слагаемые:

2Zrт + ZrCl4г + 2Cl2г = 2ZrCl2г + ZrCl4г
Разделим левую и праву части на 2:
Zrт + Cl2г = ZrCl2г
Рассчитаем энтальпию образования ZrCl2:
[(а) + (б)]:2=(215-867):2= -326
Рассчитаем энтропию образования ZrCl2:
[(а) + (б)]:2=(208-116):2= 46
Рассчитаем энергию Гиббса образования ZrCl2:
[(а) + (б)]:2=(153-832):2= -226
fH0298(ZrCl2г)=-326 кДж/моль
S0298(ZrCl2г)= 46Дж/моль∙К
fG0298(ZrCl2г)=-226 кДж/моль
Задание 3.
Задание 3 содержит материал по теме «Химическое равновесие». В таблице 3 приведены исходные данные одного из вариантов для выполнения всех пунктов задания 3.
Таблица 3
№№ |
Реакция |
Т |
Кр |
Т1, Т2 |
1 |
С2Н2 + Н2 ↔ С2Н4 |
600, 1000, 1500 |
1,19·109 5·102 3,09·10-1 |
800, 1400 |
3.1. Исходя из приведенных в табл.3 значений констант равновесия Кр при разных температурах, обсудите вопрос о выходе продуктов в ходе Вашей реакции с ростом (уменьшением) температуры. Напишите выражение константы равновесия Вашей реакции, считая, что все вещества находятся в газовой фазе.
Решение:
Данное задание не требует каких либо математических расчетов. Сравним и проанализируем данные по температурам и значениям констант равновесия: с увеличением температуры константа равновесия уменьшается, следовательно, равновесие реакции сдвигается вправо в сторону исходных веществ и выход продуктов уменьшается. Согласно принципу Ле Шателье реакция дегидрирования ацетилена является экзотермической реакцией.
Выражение для константы равновесия:
КР
=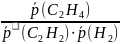
3.2. Используя значения Кр при разных температурах, определите термодинамические характеристики реакции (∆rH0т, ∆rS0т ∆rG0т). Какие допущения Вы сделали? Значения температуры выберите сами.
Решение:
Определим термодинамические характеристики данной реакции при 298К, используя значения Кр при температурах 1000К и 1500К. Для расчета воспользуемся выражениями для энергии Гиббса:
rG0T = rH0298 – T∙rS0298 и rG0T = -RTln(Кp);
Допустим, что rH0 и rS0 не зависят от температуры. Составим систему из двух уравнений с двумя неизвестными (Т1=1000; Т2=1500):
rG0T1 = rH0298 – T1∙rS0298 = -RT1ln(Кp1);
rG0T2 = rH0298 – T2∙rS0298 = -RT2ln(Кp2);
Для упрощения записи обозначим rH0298=х, а rS0298=у, тогда
х – 1000у = -8,31∙1000 ln500,
х – 1500у = -8,31∙1500 ln0,309,
Вычтем из уравнения (2) уравнение (1) и определим у:
500 у = -8,31∙1000∙ln500+8,31∙1500∙ln0,309
у
=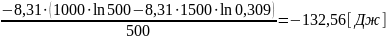
Определим значение х:
х = -8,31∙1000∙ln500 - 1000∙132,56 = -184,2 [кДж]
х = rH0298= -184,2 кДж
у = rS0298= -132,56 Дж/К
rG0298 = rH0298 – 298∙rS0298= -184,2 + 39502,88∙10-3 = -144,7 к Дж
rH0298= -184,2 кДж
rS0298= -132,56 Дж/К
rG0298 = -144,7 кДж
