- •1.Строение атома и атомного ядра. Изотопы
- •Квантовый характер излучения и поглощения энергии атомом. Уравнение Планка. Постулаты Бора.
- •Постулаты Бора
- •2.Атомные орбитали. Форма орбиталей. Многоэлектронные атомы. Принцип Паули. Правило Хунда .
- •Электронные конфигурации атомов
- •8. Связь периодической системы со строением атома
- •9. Структура периодической системы
- •10.Современная формулировка периодического закона. Периодичность изменения свойств элементов в периодах и группах на примере ряда элементов Al-Si-p-As-Sb (Be-Mg-Ca-Sc-Ti-V; p-s-Cl-Br-I; n-p-As-Se-Br).
- •11.Изменение кислотно-основных свойств соединений типа э-о-н по периодам и группам периодической системы. Периодический закон д. И. Менделеева
- •Физический смысл химической периодичности
- •Параметры ковалентной связи
- •Длина химической связи
- •Валентные углы
- •Энергия ковалентной связи
- •Вопрос 18
- •4.5.1. Самопроизвольные процессы
- •4.5.2 Энтропия
- •4.5.3. Расчет изменений энтропии
- •4.5.4. Направление химических реакций в изолированных системах. Второй закон термодинамики
- •4.5.5. Направление химических реакций в неизолированных системах. Энтальпийный и энтропийный факторы химических реакций. Энергия гиббса
- •4.5.6. Расчет величины g
- •4.5.7. Энергия гиббса и температура
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41.
- •Вопрос 42
- •Растворы электролитов
Параметры ковалентной связи
Совокупность атомов, образующих химическую частицу, существенно отличается от совокупности свободных атомов. Образование химической связи приводит, в частности, к изменению радиусов атомов и их энергии. Происходит также перераспределение электронной плотности: повышается вероятность нахождения электронов в пространстве между связываемыми атомами.
Длина химической связи
При образовании химической связи всегда происходит сближение атомов - расстояние между ними меньше, чем сумма радиусов изолированных атомов:
r(A−B) < r(A) + r(B)
Радиус атома водорода составляет 53 пм, атома фтора − 71 пм, а расстояние между ядрами атомов в молекуле HF равно 92 пм:

Межъядерное расстояние между химически связанными атомами называется длиной химической связи.
Во многих случаях длину связи между атомами в молекуле вещества можно предсказать, зная расстояния между этими атомами в других химических веществах. Длина связи между атомами углерода в алмазе равна 154 пм, между атомами галогена в молекуле хлора - 199 пм. Полусумма расстояний между атомами углерода и хлора, рассчитанная из этих данных, составляет 177 пм, что совпадает с экспериментально измеренной длиной связи в молекуле CCl4. В то же время это выполняется не всегда. Например, расстояние между атомами водорода и брома в двухатомных молекулах составляет 74 и 228 пм, соответственно. Среднее арифметическое этих чисел составляет 151 пм, однако реальное расстояние между атомами в молекуле бромоводорода равно 141 пм, то есть заметно меньше.
Расстояние между атомами существенно уменьшается при образовании кратных связей. Чем выше кратность связи, тем короче межатомное расстояние.
Длины некоторых простых и кратных связей
|
Связь |
Длина (пм) |
Связь |
Длина (пм) |
|
С−С |
154 |
С−О |
143 |
|
С=С |
133 |
С=О |
123 |
|
С≡С |
131 |
С≡O |
113 |
Валентные углы
Направление ковалентных связей характеризуется валентными углами - углами между линиями, соединяющими связываемые атомы. Графическая формула химической частицы не несет информации о валентных углах. Например, в сульфат-ионе SO42− валентные углы между связями сера−кислород равны 109,5o, а в тетрахлоропалладат-ионе [PdCl4]2− − 90o. Совокупность длин связей и валентных углов в химической частице определяет ее пространственное строение. Для определения валентных углов используют экспериментальные методы изучения структуры химических соединений. Оценить значения валентных углов можно теоретически, исходя из электронного строения химической частицы.
Энергия ковалентной связи
Химическое соединение образуется из отдельных атомов только в том случае, если это энергетически выгодно. Если силы притяжения преобладают над силами отталкивания, потенциальная энергия взаимодействующих атомов понижается, в противном случае − повышается. На некотором расстоянии (равном длине связи r0) эта энергия минимальна.
Таким образом, при образовании химической связи энергия выделяется, при ее разрыве − поглощается. Энергия E0, необходимая для того, чтобы разъединить атомы и удалить их друг от друга на расстояние, на котором они не взаимодействуют, называется энергией связи. Для двухатомных молекул энергия связи определяется как энергия диссоциации молекулы на атомы. Она может быть измерена экспериментально.
В молекуле водорода энергия связи численно равна энергии, которая выделяется при образовании молекулы Н2 из атомов Н:
Н + Н = Н2 + 432 кДж
Эту же энергию нужно затратить, чтобы разорвать связь Н-Н:
H2 = H + H − 432 кДж
Типы гибридизации атомных орбиталей
Пространственное строение молекул. Представления о природе ковалентных связей с учетом типа орбиталей, участвующих в образовании химической связи, позволяют делать некоторые суждения о форме молекул.
Если химическая связь образуется с помощью электронов s-орбиталей, как, например, в молекуле Н2, то в силу сферической формы s-орбиталей не существует никакого преимущественного направления в пространстве для наиболее выгодного образования связей. Электронная плотность в случае р-орбиталей распределена в пространстве неравномерно, поэтому появляется некоторое выделенное направление, вдоль которого наиболее вероятно образование ковалентной связи.
Рассмотрим примеры, которые позволяют понять общие закономерности в направленности химических связей. Обсудим образование связей в молекуле воды H2O. Молекула H2O образуется из атома кислорода и двух атомов водорода. Атом кислорода имеет два неспаренных электрона, которые занимают две орбитали, расположенные под углом 90° друг к другу. Атомы водорода имеют неспаренные 1s-электроны. Ясно, что углы между двумя связями О—Н, образованными р-электронами атома кислорода с s-электронами атомов водорода, должны быть прямыми или близкими к нему (см. рис.).
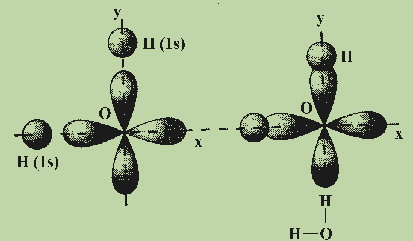
Аналогично, прямыми должны быть углы между связями в молекулах Н2О, H2S, F2О. Cl2O, РН3, РСl3 и т. д. Действительные значения углов между связями заметно отличаются от теоретических.
Увеличение валентных углов (> 90°) вполне объяснимо взаимным отталкиванием не связанных друг с другом атомов, которое мы не учитывали при предсказании углов между связями. Так, взаимное отталкивание атомов водорода в молекуле H2S слабее, чем в молекуле Н2О (так как радиус атома серы больше радиуса атома кислорода), поэтому и валентные углы Н—S—Н ближе к 90°, чем углы Н—О—Н.
Таким образом, двухвалентный атом неметалла с двумя валентными р-орбиталями образует изогнутую (угловую, с углом, близким к 90°) молекулу, а трехвалентный атом с тремя валентными р-орбиталями образует молекулу, имеющую форму пирамиды.
Гибридизация орбиталей. Рассмотрим образование молекулы метана СН4. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя р-электронами — ls22sl2p3.
Рассуждая как в случае H2O, можно было бы предполагать, что атом углерода будет образовывать три связи С—Н, направленные под прямым углом друг к другу (р-электроны), и одну связь, образованную s-электроном, направление которой было бы произвольным, поскольку s-орбиталь имеет сферическую симметрию.
Следовательно, можно было ожидать, что три связи С—Н в СН4 являются направленными p-связями и совершенно одинаковы, а четвертая связь есть ненаправленная s—s-связь и отличается от первых трех.
Однако экспериментальные данные показали, что все четыре связи С—Н в молекуле метана СН4 одинаковы и направлены к вершинам тетраэдра (угол между ними составляет 109,5°).
Ввиду относительной близости значений энергии 2s- и 2p-электронов эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
Четыре sp3-гибридные орбитали атома углерода расположены под углом 109,5° друг к другу, они направлены к вершинам тетраэдра, в центре которого находится атом углерода. Гибридная орбиталь сильно вытянута в одну сторону от ядра (см. рис.).
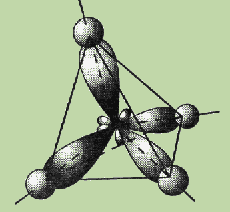
Это обусловливает более сильное перекрывание таких орбиталей с орбиталями электронов других атомов по сравнению с перекрыванием s- и р-орбиталей и приводит к образованию более прочных связей.
Таким образом, при образовании молекулы метана различные орбитали валентных электронов атома углерода — одна s-орбиталь и три р-орбитали — превращаются в четыре одинаковые “гибридные” sр3-орбитали (sp3-гибридизация). Этим и объясняется равноценность четырех связей атома углерода в молекуле.
Гибридизация оказывается характерной не только для соединений атома углерода. Гибридизация орбиталей может происходить в том случае, когда в образовании связей одновременно участвуют электроны, которые принадлежат к различным типам орбиталей.
Р ассмотрим
примеры различных видов гибридизации
s- и р-орбиталей. Гибридизация одной
s- и одной р-орбиталей (sp-гибридизация)
происходит при образовании галогенидов
бериллия, например BeF2, цинка,
ртути, молекулы ацетилена и др. Атомы
этих элементов в основном состоянии
имеют на внешнем слое два спаренных
s-электрона. В результате возбуждения
один из электронов s-орбитали переходит
на близкую по энергии р-орбиталь, т. е.
появляются два неспаренных электрона,
один из которых s-электрон, а другой
р-электрон. При возникновении химической
связи эти две различные орбитали
превращаются в две одинаковые гибридные
орбитали (тип гибридизации — sp),
направленные под углом 180° друг к другу,
т. е. эти две связи имеют противоположное
направление (см. рис.).
ассмотрим
примеры различных видов гибридизации
s- и р-орбиталей. Гибридизация одной
s- и одной р-орбиталей (sp-гибридизация)
происходит при образовании галогенидов
бериллия, например BeF2, цинка,
ртути, молекулы ацетилена и др. Атомы
этих элементов в основном состоянии
имеют на внешнем слое два спаренных
s-электрона. В результате возбуждения
один из электронов s-орбитали переходит
на близкую по энергии р-орбиталь, т. е.
появляются два неспаренных электрона,
один из которых s-электрон, а другой
р-электрон. При возникновении химической
связи эти две различные орбитали
превращаются в две одинаковые гибридные
орбитали (тип гибридизации — sp),
направленные под углом 180° друг к другу,
т. е. эти две связи имеют противоположное
направление (см. рис.).
Экспериментальное определение структуры молекул BeX2, ZnX2, HgX2, C2H2 и т. д. (X — галоген) показало, что эти молекулы действительно являются линейными.
Остановимся подробнее на структуре молекулы ацетилена С2Н2. В молекуле ацетилена каждый атом углерода образует две гибридизированные связи, направленные под углом 180° друг к другу (см. рис.).
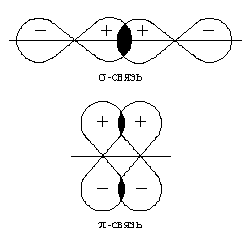
Как при образовании связей С—С, так и при образовании связей С—Н возникает общее двухэлектронное облако, образуя s -связи. В общем случае s -связью можно назвать связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.

Но в молекуле ацетилена атомы углерода находятся в sp-гибридных состояниях, т. е. в каждом из атомов углерода содержится еще по два р-электрона, которые не принимали участие в образовании s -связей. Молекула ацетилена имеет плоский линейный скелет, поэтому оба р-электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. В этом случае происходит также некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании s -связей. Таким образом, в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые p -связями (см. рис.).
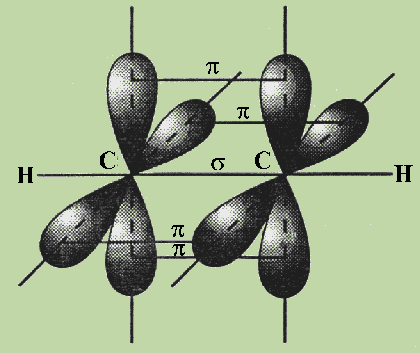
Случай образования кратных связей между атомами углерода для молекулы ацетилена — случай образования тройной связи, которая состоит из одной s - и двух p -связей. s -Связи являются более прочными, чем p -связи.
Еще один вид гибридизации s- и p-орбиталей осуществляется, например, в соединениях бора, алюминия или углерода (этилен бензол). Возбужденный атом бора имеет один s- и два p-электрона. В этом случае при образовании соединений бора происходит гибридизация одной s- и двух p-орбиталей (ps2-гибридизация), при этом образуется три одинаковые sp2–гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу (см. рис.).
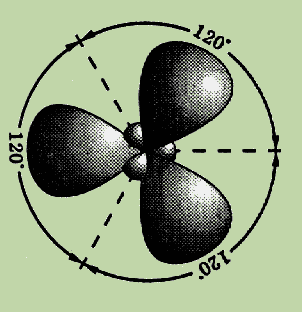
Эксперименты показали, что такие соединения как BF3, AlCl3, а также этилен и бензол имеют плоское строение и все три связи Bѕ F(в молекуле BF3) расположены под углом 120° друг к другу.
Посредством образования sp2-гибридных орбиталей объясняются и структуры непредельных углеводородов.
Вопросы 13-17.
13. Дайте определение параметров ковалентной связи: длина, угол связи, энергия связи. Почему углы между связями в молекулах CH4 и SiH4 одинаковы, а у молекул H2O и H2S – различны (у молекул NH3 и AsH3 – различны)?
14. По методу валентных связей покажите образование молекул NH3 и H2Se (угол 91 о) [CH4 и BF3; HCl и COCl2; C2H2 и H2Te]. Раскройте физический смысл свойств ковалентной связи: насыщаемость и направленность.
15. Определите тип гибридизации атомных орбиталей центрального атома в молекулах BeCl2, BCl3, CCl4. Покажите форму перекрывающихся атомных орбиталей и величину валентных углов.
16. Раскройте физический смысл свойства ковалентной связи «насыщаемость». Определите тип гибридизации атомных орбиталей азота в молекуле NH3 (BF3) и ионе NH4+ (BF4– ). Определите величину валентных углов.
17. Покажите образование молекулы О2 (NO, В2, N2, CN, F2) по методу валентных связей.
Ковалентная связь. Механизм ее образования: обменные и донорно-акцепторный. Метод валентных связей. Гибридизация атомных орбиталей; виды гибридизации. Геометрическая конфигурация молекул. Свойства ковалентной связи: направленность, насыщаемость, полярность. Электрический (дипольный) момент связи и молекулы.
Ковалентная связь - это связь, возникающая между атомами за счет образования общих электронных пар. В основе ее также лежит представление о приобретении атомами энергетически выгодной и устойчивой электронной конфигурации из 8 электронов (для атома водорода из 2). Такую конфигурацию атомы получают не путем отдачи или присоединения электронов как в ионной связи, а посредством образования общих электронных пар. Механизм образования такой связи может быть обменный или донорно-акцепторный. К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Например водород: Н2 Н. +Н. →Н:Н или Н-Н. Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов. У каждого атома есть по одному s –электрону. Атомы Н равноценны и пары одинаково принадлежат обоим атомам. По этому же принципу происходит образование общих электронных пар (перекрывание р-электронных облаков) при образовании молекулы Сl2. При образовании молекулы N2 Образуются 3 общие электронные пары. Перекрываются р-орбитали. Связь называется неполярная. При образовании молекулы хлороводорода перекрывается орбиталь s-электрона водорода и орбиталь р-электрона хлора Н-Сl. Связывающая электронная пара смещена к атому хлора, в результате чего образуется диполь, который измеряется дипольным моментом. Связь называется полярная. По донорно-акцепторному механизму происходит образование иона аммония. Донор (азот) имеет электронную пару, акцептор – (Н+) свободную орбиталь, которую пара электронная азота может занять. В ионе аммония три связи азота с водородом образованы по обменному механизму, а одна по донорно-акцепторному. Все 4 связи равноценны. Ковалентные связи классифицируют не только по механизму образования общих электронных пар, соединяющих атомы, но и по способу перекрывания электронных орбиталей , по числу общих пар, а также по смещению их. По способу перекрывания – σ (сигма s- s, s-р, р-р) π (р-р гантели перекрываются двумя местами). В молекуле азота между атомами существуют одна σ-связь и две π-связи, которые находятся в двух взаимно перпендикулярных плоскостях. По числу общих электронных пар различают: одинарные Н2, НСl; двойные С2Н4, СО2; тройные N2. По степени смещенности: полярные и неполярные. Связь между атомами с одинаковой электроотрицательностью – неполярная, с разной – полярная. Исследования ученых позволили сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами. Каждый электрон занимает место в квантовых ячейках обоих атомов, т.е. движется в силовом поле, образованном двумя силовыми центрами – ядрами атомов водорода. Это представление о механизме образования химической связи было развито учеными Гейтлером и Лондоном на примере водорода.это было распространено и на более сложные молекулы. Разработанная на этой основе теория образования химической связи получила название метода валентных связей. Метод ВС дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул. Хотя этот метод не оказался универсальным и в ряде случаев не в состоянии правильно описать структуру и свойства молекул – все же он сыграл большую роль в разработке квантово-механической теории химической связи и не потерял своего значение до настоящего времени. В основе метода ВС лежат следующие положения: - ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. -ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Геометрическая форма s –орбитали сферическая, от центра к краям размазанная (более плотная у ядра, и менее- на краях). Орбитали р-электронов представляют собой гантели, направленные вдоль осей координат. Облака d –электронов имеют более сложную форму. Метод гибридизации орбиталей исходит из предположения, что при образовании молекул вместо исходных s-, р-, d-,f- орбиталей (облаков) образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается более полное их перекрывание с электронными облаками других атомов. На гибридизацию затрачивается энергия, за то она окупается более полным перекрыванием. Получается более прочная молекула. Затраченная на гибридизацию энергия окупается энергией, выделяющейся при образовании связи. Пример –молекула метана.В результате перекрывания четырех гибридных sр3 орбиталей атома углерода и 4 s орбиталей 4-х атомов водорода, образуется тетраэдрическая модель молекулы метана с четырьмя σ связями, под углом 1090. Если в молекуле гибридизуется 3-р орбитали, то sр2 гибридизация – молекула этилена, если 2 орбитали sр – гибридизция (ацетилен). У элементов 3 и последующих периодов в образовании гибридных облаков участвуют и d-электроны. В этом случае образуются 6 равноценных гибридных облака, вытянутых к вершинам октаэдра sр3 d2-гибридизация. Такую гибридизацию имеет центральный атом комплексного иона. Этим объясняется их октаэдрическая структура. Ковалентная связь обладает направленностью. Область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Характер распределения электронов по молекулярным орбиталям позволяет объяснить магнитные свойства частиц. Молекулы, суммарный спин которых равен нулю, проявляют диамагнитные свойства, т.е. во внешнем магнитном поле их собственные магнитные моменты ориентируются против направления поля. Молекулы, суммарный спин которых отличен от нуля, проявляют парамагнитные свойства, т.е. во внешнем магнитном поле их собственные магнитные моменты ориентируются в направлении поля. Таким образом молекула Н2 диамагнитна. Геометрическая форма молекул зависит от направленности химической связи. Ядра атомов молекул имеющих sр-гибридизацию атомных орбиталей расположены в одной плоскости, sр2 –направлены к вершинам треугольника, sр3 – к верщинам тетраэдра.
Свойства ковалентной связи: насыщаемость, направленность и поляризуемость.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
|
|
После образования между двумя атомами -связи для остальных электронных облаков той же формы и с тем же главным квантовым числом * остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется p-связь. Она менее прочна, чем -связь: перекрывание происходит диффузными боковыми частями орбиталей. Каждая кратная связь (например, двойная или тройная) всегда содержит только одну -связь. Число -связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа. Термин "координационное число" используется также в других областях химии. В случае комплексных соединений он означает количество лигандов, окружающих центральный ион. В кристаллохимии координационное число показывает количество атомов кристаллической решетки, соседних с данным атомом.. Например, в молекуле NH3 и ионе NH4+ для атома азота оно равно трем и четырем. Образование -связей фиксирует пространственное положение атомов относительно друг друга, поэтому число -связей и углы между линиями связи, которые называются валентными углами, определяют пространственную геометрическую конфигурацию молекул.
При оценке степени перекрывания электронных облаков следует учитывать знаки волновых функций электронов. При перекрывании облаков с одинаковыми знаками волновых функций электронная плотность в пространстве между ядрами возрастает. В этом случае происходит положительное перекрывание, приводящее к взаимному притяжению ядер. Если знаки волновых функций противоположны, то плотность электронного облака уменьшается (отрицательное перекрывание), что приводит к взаимному отталкиванию ядер.
Поляризуемость рассматривают на основе представлений о том, что ковалентная связь может быть неполярной (чисто ковалентной) или полярной .
Важными характеристиками химической связи являются также ее длина и кратность. Длина связи определяется расстоянием между ядрами связанных атомов в молекуле. Как правило, длина химической связи меньше, чем сумма радиусов атомов, за счет перекрывания электронных облаков. Кратность связи определяется количеством электронных пар, связывающих два атома, например:
этан H3C–CH3 одинарная связь (-связь)
этилен H2C=CH2 двойная связь (одна -связь и одна -связь)
ацетилен HCCH тройная связь (одна -связь и две -связи).
С увеличением кратности возрастает энергия связи, однако это возрастание не пропорционально кратности, т.к. -связи менее прочны, чем -связь.