
- •ПРЕДИСЛОВИЕ ПЕРЕВОДЧИКА
- •ПРЕДИСЛОВИЕ
- •СПИСОК СОКРАЩЕНИЙ
- •1. Введение
- •1.1. Освещение по Кёлеру
- •1.1.1. Принципы метода
- •1.1.2. Предварительная проверка оборудования
- •1.2. Установка света по Кёлеру
- •2.1. Преломление
- •2.1.1. Числовая апертура
- •2.2. Отражение, поглощение и пропускание
- •2.3. Флуоресценция/фосфоресценция
- •2.4. Поляризация
- •2.5. Дифракция
- •2.5.1. Тестовые пластинки Аббе
- •2.5.2. Формирование первичного изображения
- •2.5.3. Разрешающая способность
- •2.5.4. Роль конденсора в разрешении микроскопа
- •2.5.5. Увеличение
- •2.5.6. Увеличение и разрешение
- •4. Поле зрения
- •5. Резюме
- •6. Литература для дальнейшего чтения
- •1. Введение
- •1.1. Определение контраста
- •2. Светлопольная микроскопия
- •3. Фазовый контраст
- •3.2. Дифрагированный свет в фазовом контрасте
- •4. Темнопольная микроскопия
- •4.1. Освещение по Рейнбергу
- •4.2. Темнопольные конденсоры высокого разрешения
- •4.3. Темнопольное изображение
- •5. Поляризованный свет
- •5.1. Использование одиночного поляризатора
- •5.2. Использование скрещенных поляризаторов
- •5.2.2. Направление двулучепреломления
- •6.3. Интерференционная отражательная микроскопия
- •6.3.2. Физические основы метода
- •6.3.3. Интерпретация результатов
- •7.1. Красители
- •7.2. Использование светофильтров
- •7.3. Срезы
- •7.4. Качество препарата
- •8. Другие методы
- •8.1. Дисперсионное окрашивание
- •10. Благодарности
- •11. Литература
- •ФИКСИРОВАНИЕ ИЗОБРАЖЕНИЯ
- •1. Введение
- •2. Рисование
- •3. Фотомикрография
- •4.1. Разрешение
- •4.2. Разрешающая способность и размер отпечатка
- •4.4. Освещение
- •5. Микроскоп для фотомикрографии
- •5.1. Штатив микроскопа
- •5.2. Оптика
- •5.2.1. Числовая апертура и увеличение объективов
- •5.2.2. Исправление аберраций
- •5.2.4. Иммерсионные объективы
- •5.2.5. Глубина резкости
- •5.2.6. Кривизна поля зрения
- •5.2.7. Типы конденсоров
- •5.2.8. Чистка линз
- •6. Камера для фотомикрографии
- •6.1. Выбор размера пленки
- •6.3. Специальная фотомикрографическая камера
- •6.4. Микроскопы со встроенными фотосистемами
- •6.5. Камера с мехами
- •7. Наведение на фокус и определение экспозиции
- •7.1. Наведение на фокус
- •7.2. Определение экспозиции
- •7.3. Контроль экспозиции
- •8. Выбор условий для фотомикрографии
- •8.1. Фотографический процесс
- •8.1.1. Чувствительность пленки
- •8.1.2. Зернистость
- •8.1.3. Контрастность
- •8.2. Черно-белая фотомикрография
- •8.3. Цветная фотомикрография
- •8.3.1. Цветные отпечатки или слайды
- •8.3.2. Печать со слайдов
- •8.3.3. Цветовая температура
- •8.3.4. Коррекция цветовых искажений
- •8.3.6. Выбор чувствительности пленки
- •8.4. Поляроидные клетки
- •8.4.2. Камера Поляроид SX70
- •8.4.3. Поляроидные слайды
- •8.5. Хранение неэкспонированной пленки
- •9. Фотомакрография
- •9.1.1. Стереомикроскопы для фотомикрографии
- •9.1.2. Макроскопы
- •9.1.3. Фотомакрографические объективы
- •9.2. Освещение для фотомакрографии
- •9.3. Определение экспозиции при фотомакрографии
- •10. Завершение процесса фотомикрографии
- •10.1. Содержание записей
- •10.2. Хранение негативов
- •10.3. Хранение слайдов
- •10.4. Монтаж слайдов
- •10.5. Хранение отпечатков
- •10.6. Определение и указание увеличения
- •11. Практическое руководство
- •11.2. Начальная калибровка экспонометра
- •12. Литература для дальнейшего чтения
- •ИММУНОГИСТОХИМИЯ
- •1. Введение
- •2. Антитела
- •2.1. Структура иммуноглобулинов
- •2.2. Поликлональная антисыворотка
- •2.3. Моноклональные антитела
- •2.4. Очистка антител
- •2.5. Специфичность реакций антител
- •2.6. Хранение антител
- •3.1. Выбор условий обработки ткани
- •3.2. Выявление скрытых антигенов
- •4. Выбор способа мечения
- •4.1. Флуоресцентные метки
- •4.2. Ферментные метки
- •4.2.1. Пероксидаза хрена
- •4.2.2. Щелочная фосфатаза
- •4.2.3. Глюкозооксидаза
- •4.2.4. Галактозидаза
- •4.3. Коллоидное золото
- •4.4. Выбор метки
- •5. Методы окраски
- •5.1. Прямой метод
- •5.2. Непрямой метод
- •5.4. Системы с использованием биотин — авидина
- •5.5. Другие методы
- •6. Экспериментальные методы
- •6.1. Общее описание метода
- •6.2. Выбор правильного разведения антител
- •6.3. Флуоресцентные метки
- •6.4. Пероксидаза
- •6.4.1. Ингибирование эндогенного фермента
- •6.5. Щелочная фосфатаза
- •6.5.1. Блокирование эндогенного фермента
- •6.5.2. Мера предосторожности
- •6.6. Глюкозооксидаза
- •6.7. Галактозидаза
- •6.9. Некоторые общие процедуры
- •6.9.1. Покрытие предметных стекол
- •6.9.2. Дополнительное окрашивание
- •7.1. Контрольные препараты
- •7.2. Решение проблем
- •9. ДНК-зонды для гибридизации in situ
- •9.1. Принцип метода гибридизации
- •9.2. Экспериментальная процедура
- •9.2.1. Выявление Y-хромосомы
- •9.2.2. Выявление цитомегаловируса
- •10. Цитологические препараты
- •11. Количественная оценка
- •12. Оборудование
- •13. Благодарности
- •14. Литература
- •ГИСТОХИМИЯ И СВЕТОВАЯ МИКРОСКОПИЯ
- •1. Введение
- •1.1. Объекты для гистохимического окрашивания
- •1.1.1. Что такое окрашивание?
- •2. Приготовление и хранение срезов препаратов
- •2.1. Необходимые характеристики препарата
- •2.2. Методы приготовления и хранения препаратов
- •2.2.1. Получение тонких слоев
- •3. Что можно выявлять? Некоторые примеры
- •3.1. Выявление химических свойств
- •3.1.1. Химические фрагменты
- •3.1.2. Специфические вещества
- •3.1.3. Классы веществ
- •3.2. Выявление биологических объектов
- •3.2.1. Биологические объекты
- •3.2.2. Биологические процессы
- •3.3. Морфологические исследования
- •4. Выбор методов
- •5.1. Оценка селективности методов
- •5.2. Оценка локализации окрашивания
- •5.4. Оценка чистоты реагентов
- •5.5. Номенклатура реагентов
- •6. Что необходимо для гистохимической работы
- •6.1. Оборудование и материалы
- •6.2. Как научиться работать?
- •7. Почему используются гистохимические методы
- •8. Благодарности
- •ФЛУОРЕСЦЕНТНАЯ МИКРОСКОПИЯ
- •1. Введение
- •2. Флуорохромы
- •3. Флуоресцентный микроскоп
- •3.1. Способы освещения
- •3.1.1. Освещение проходящим светом
- •3.1.2. Освещение падающим светом
- •3.2. Источники света
- •3.3. Домики для ламп
- •3.4. Фильтры
- •3.4.1. Возбуждающие фильтры
- •3.4.2. Запирающие фильтры
- •3.4.3. Цветные светоделительные зеркала
- •3.5. Объективы и окуляры
- •4. Применение флуоресцентных красителей
- •4.1. Нуклеиновые кислоты
- •4.1.1. Прижизненное окрашивание флуорохромами
- •4.2. Иммунофлуоресценция
- •4.3. Флуоресценция нейромедиаторов
- •4.4. Двойное окрашивание
- •5. Микрофлуориметрия
- •5.1. Введение
- •5.2. Стандарты флуоресценции
- •5.3. Оборудование
- •5.3.1. Инвертированные микрофлуориметры
- •5.3.2. Сканирующие микрофлуориметры
- •5.4. Измерения содержания ДНК
- •5.4.1. Оборудование
- •5.4.2. Подготовка материала
- •5.4.3. Процедура окрашивания
- •5.4.4. Проведение измерений
- •6. Анализ изображения при флуоресценции
- •7. Сканирующая лазерная микроскопия
- •8. Литература
- •МИКРОМЕТРИЯ И АНАЛИЗ ИЗОБРАЖЕНИЯ
- •1. Введение
- •2. Простая микрометрия
- •2.1. Измерения длины
- •2.1.3. Окуляр-микрометр сдвига
- •2.1.4. Другие методы измерения длины
- •2.2 Измерения углов
- •2.3. Измерение толщины
- •2.4. Счетные камеры
- •2.4.2. Техника работы с гемоцитометром
- •3.1.1. Определение АA в двухфазном препарате
- •3.2. Принципы измерения площади поверхности
- •4. Измерения с использованием дигитайзера
- •5.2. Измерения с помощью компьютера
- •6. Приборы и математическое обеспечение работ
- •7. Литература
- •ВИДЕОМИКРОСКОПИЯ
- •1. Видеомикроскопия и оборудование для нее
- •1.1. Введение
- •1.1.1. Видеоусиление
- •1.1.2. Видеоинтенсификация
- •1.1.3. Цифровая обработка изображения
- •1.2.1. Условия ограниченного числа фотонов
- •1.3. Различные методы видеомикроскопии
- •1.3.1. Видеомикроскопия с усилением
- •1.3.2. Аналоговое усиление контраста
- •1.3.3. Цифровая обработка изображения
- •1.4.1. Камеры и контроллеры камер
- •1.4.5. Видеопроцессорные платы
- •1.4.6. Монофункциональные процессоры
- •1.4.7. Взгляд в будущее
- •1.5. Условия, налагаемые на микроскоп
- •1.6. Как соединить телекамеру с микроскопом
- •2.1. Различные виды VEC-микроскопии
- •2.2. Приготовление препаратов
- •2.3. Получение изображения
- •2.4. Интерпретация изображений
- •2.5. Типичные применения и ограничения метода
- •2.5.1. Светлопольная микроскопия
- •2.5.2. Темнопольная микроскопия
- •2.5.4. Фазовый контраст
- •2.5.5. Поляризационная микроскопия
- •2.5.7. Отражательная контрастная микроскопия
- •2.5.8. Флуоресцентная микроскопия
- •2.5.9. Примеры применения в биологии и биохимии
- •3.1. Введение
- •3.2. Процесс формирования изображения
- •3.2.1. Условия, касающиеся микроскопа
- •3.2.2. Получение статических изображений
- •3.2.3. Получение изображений подвижных объектов
- •3.3. Типичные приложения
- •3.3.2. Картирование отношений
- •3.3.4. Визуализация молекул
- •3.3.6. Люминесценция
- •3.3.7. Нейробиология
- •4.1. Пространственные измерения
- •4.2. Измерения по интенсивности
- •5.1. Видеозапись и редактирование
- •5.1.1. Стандарты видеотехники
- •5.1.2. Форматы видеопленок
- •5.1.3. Качество видеопленок
- •5.1.4. Видеомагнитофоны
- •5.1.5. Видеомагнитофоны с цейтраферной записью
- •5.1.6. Запись при видеомикроскопии
- •5.1.8. Копирование и редактирование видеозаписей
- •5.2.1. Оборудование
- •5.3. Перенос видеозаписей в видеофильм
- •5.4. Рисование с монитора
- •6. Благодарности
- •7. Литература
- •1. Введение
- •2. Классификация сегментов хромосом
- •2.1. Гетерохроматиновые сегменты
- •2.2. Эухроматиновые сегменты
- •2.3. Ядрышковые организаторы
- •2.4. Кинетохоры
- •4.2. G-окрашивание
- •4.2.1. ASG-метод
- •4.2.3. Метод Галлимора и Ричардсона
- •4.3. R-окрашивание
- •4.4. Q-окрашивание
- •4.4.1. Q-окрашивание с помощью акрихина
- •4.5.2. Процедура окраски
- •5.1. Окрашивание ДАФИ/дистамицином
- •5.2.1. Метод культивирования клеток
- •5.2.2. Методика окраски
- •5.3.2. Синхронизация с помощью БУДР [39]
- •5.3.3. Синхронизация с помощью ФУДР [13, 40]
- •6. Наблюдение и регистрация сегментов хромосом
- •6.3. Фотографирование сегментированных хромосом
- •6.4.1. Получение профилей сегментов
- •6.4.2. Отражательная микроскопия
- •6.4.3. Измерение полиморфизма хромосом
- •7. Благодарности
- •8. Литература
- •9. Литература для дальнейшего чтения
ухудшению или к полному исчезновению дифференциального окрашивания. Однако изменение рН приводит к появлению G-сегментов при значениях рН между 5,5 и 6,7 [24]. Если два типа окраски надо получить последовательно, то G-окраску следует делать первой; практические подробности можно найти в работе Бактона [25].
4.4. Q-окрашивание
Метод Q-окрашивания был не только разработан первым из современных методов дифференциального окрашивания хромосом, но и оказался одним из наиболее полезных. С его помощью могут быть выявлены как гетерохроматиновые, так и некоторые эухроматиновые сегменты. Таким образом, Q-окрашивание представляет собой ценный метод для анализа хромосом высших позвоночных, а также хромосом насекомых и растений, идентификация которых в значительно большей степени зависит от особенностей гетерохроматиновых сегментов. Гетерохроматиновые сегменты могут давать яркую или бледную флуоресценцию с акрихином, кроме того, их размеры изменчивы. Таким образом, Q-окрашивание является одним из немногих методов, позволяющих охарактеризовать гетерохроматин более детально, чем это можно сделать с помощью одной R- окраски.
Метод проведения Q-окраски прост в исполнении, он применяется во многих областях и по сравнению с другими методами дифференциального окрашивания дает наиболее хорошо воспроизводимые результаты. Недостатками Q-окраски являются: нестабильность препаратов, выцветание флуоресценции препарата под действием света и, конечно, необходимость использовать специальный флуоресцентный микроскоп. Исходный метод основывался на применении акрихиниприта, однако в настоящее время в основном используется акрихин, который дешевле и, вероятно, безопаснее, хотя с обоими веществами следует обращаться осторожно из-за их потенциально мутагенных свойств. Недавно для Q-окрашивания был предложен спермидин-бис- акридин — вещество, обладающее более стабильной флуоресценцией. Несмотря на то, что данное вещество надо готовить непосредственно в лаборатории, выигрыш, достигаемый за счет большей устойчивости флуорохрома к выцветанию, настолько велик, что мы описываем здесь синтез красителя.
4.4.1. Q-окрашивание с помощью акрихина
Акрихин (от англ. — quinacrine) выпускается многими фирмами под разными названиями: атабрин, атебрин, мепакрин, акрихин гидрохлорид или дигидрохлорид,— относящимися к одному и тому же веществу. Процедура окрашивания акрихином очень проста:
1.Окрасьте препарат хромосом в течение 6—10 мин 0,5%-ным водным раствором акрихина.
2.Промойте препарат под струей проточной воды в течение 3 мин.
3.Промойте препарат дистиллированной водой.
4.Заключите препарат в дистиллированную воду. Для того чтобы удалить как можно больше воды, прижмите к покровному стеклу сверху фильтровальную бумагу. Залейте края покровного стекла резиновым клеем; для этой цели хорошо подходит достаточно жидкий резиновый клей, такой как Pang Supersolution [Pang (Великобритания) Ltd.].
На рис. 9.5 приведен пример Q-окраски хромосом человека. Препарат наблюдают с помощью флуоресцентного микроскопа при сине-фиолетовом освещении (разд. 6.2). Метод очень неприхотлив, он дает хорошие результаты в широком диапазоне концентраций красителя и длительности окрашивания. При этом, как и во всех случаях дифференциального окрашивания, наилучшие результаты получаются при использовании высококачественных препаратов хромосом.
Некоторые авторы предлагают заключать препараты не в воду, а в буфер или в буфер с глицеролом. Но эти способы не дают, по-видимому, больших преимуществ, а избыток глицерола ведет к появлению равномерной флуоресценции всех хромосом. Заключенные препараты можно хранить в холодильнике в течение ночи или одного-двух дней без значительного ухудшения морфологии дифференциально окрашенных хромосом, однако при любом сроке хранения они неизбежно выцветают.
199
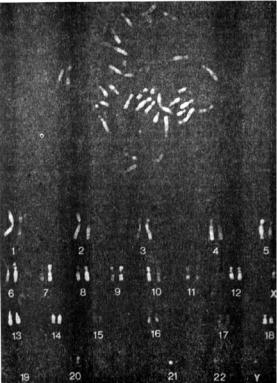
Рис. 9.5. Метафазная пластинка (вверху) и кариотип лимфоцита человека,, Q-окраска.
Воспроизводится с разрешения по Bostock, С. J., Sumner, А. Т.. (1978), The Eukaryotic Chromosome, copyright Elsevier Science Publishers BV.
4.4.2. Изготовление спермидин-бис-акридина и его применение при Q-окрашивании
Спермидин-бис-акридин, представляя собой димерный аналог акрихина, позволяет получать более яркие, контрастные и стабильные Q-сегменты [26]. Это вещество не поступает в продажу, и его надо готовить в лаборатории. Способ изготовления следующий:
1)растворите 4 г NaOH в 60 г расплавленного фенола при 100 °С;
2)добавьте при встряхивании 14 г дихлорметоксиакридина (Aldrich);
3)выдержите смесь в течение 1,5 ч при 100 °С, затем влейте ее в 500 мл 2 М NaOH, перемешайте и оставьте остывать на ночь;
4)отфильтруйте осадок, промойте его водой и высушите. Полученное вещество является феноксиакридином;
5)растворите 8,68 г феноксиакридина в 27,6 г фенола при 80 °С в открытой посуде;
6)добавьте 2,0 г спермидина;
7)увеличьте температуру до 120 °С и продолжайте нагревать в течение 1 ч;
8)раствор охладите и влейте в эфир;
9)промойте материал эфиром, вновь растворите его в горячем метаноле и опять осадите эфиром. Отфильтруйте осадок на воронке Бюхнера, промойте эфиром и высушите. Осадок представляет собой спермидин-бис-акридин;
10)спермидин-бис-акридин следует хранить в плотно закрытом контейнере в холодильнике.
При проведении данного синтеза следует предпринимать меры предосторожности, так как в нем используются опасные ингредиенты. Вся работа должна выполняться в хорошо работающем вытяжном шкафу и с использованием соответствующей защитной одежды.
Процедура окрашивания с использованием спермидин-бис-акридина аналогична методике с использованием акрихина, но в первой применяется более разбавленный раствор.
1.Растворите 5 мг спермидин-бис-акридина в 1 мл метанола, добавьте 99 мл 0,01 М фосфатного буфера (рН 6,5) и окрашивайте препарат хромосом полученным раствором в течение 10 мин.
2.Промойте стекла двумя сменами фосфатного буфера (рН 6,5) в течение 1 мин и заключите препараты в тот же буфер, прижимая покровные стекла и удаляя лишний буфер, как описано выше в методе окрашивания акрихином (разд. 4.4.1). Условия наблюдения точно те же, что и для препаратов, окрашенных акрихином.
4.5. Окрашивание ядрышковых организаторов серебром
Ядрышковые организаторы хромосом можно окрасить серебром с помощью различных методов. При этом окрашиваются в основном белки, связанные с ядрышковыми организаторами, а не собственно гены 18S и 28S рРНК; интенсивность окраски зависит от степени активности рибосомных генов. Подобно С-окраске серебрение ядрышковых организаторов часто позволяет выявлять их полиморфизм [1].
Здесь приводится метод серебрения, описанный в работе Ховелла и Блэка [27].. В нем используются два
200
исходных концентрированных раствора, которые смешивают непосредственно перед употреблением. 4.5.1. Исходные растворы
1. AgNO3: растворите 4 г AgNO3 в 8 мл деионизованной воды. Данный раствор стабилен при хранении в темноте, но если появилось заметное почернение, его следует вылить.
2. Коллоидный проявитель: растворите 2 г желатины в 100 мл деионизованной воды и добавьте 1 мл чистой муравьиной кислоты. Колбу следует довольно долго встряхивать и, если необходимо, подогревать до тех пор, пока не растворится вся желатина. Раствор следует использовать в течение двух недель со дня приготовления.
4.5.2. Процедура окраски
1.Смешайте в маленькой пробирке 2 капли коллоидного проявителя с 4 каплями раствора AgNO3 и нанесите смесь пипеткой на предметные стекла с препаратами хромосом. Накройте препараты покровными стеклами.
2.Поместите предметные стекла на поверхность нагретого примерно до 70 °С нагревательного столика. Красящий раствор станет сначала бледно-желтым, а затем золотисто-коричневым.
3.Когда раствор станет золотисто-коричневым (через 1— 2 мин), смойте покровные стекла и краситель струей деионизованной (или дистиллированной) воды.
4.Промокните предметные стекла и дайте им полностью высохнуть. Заключите препарат в DPX или в аналогичную среду.
Данный метод позволяет окрасить ядрышковые организаторы в черный цвет, в то время как плечи хромосом
ився цитоплазма остаются желтыми (рис. 9.6). Фон может быть чистым, но при использовании старых стекол, на которых могли осесть частички пыли, может появляться грязный фон, так как серебро откладывается на любом материале.
Данный метод удобен, он дает хорошие результаты на препаратах различного качества даже при незначительных изменениях в продолжительности обработки, температуре и соотношении двух исходных растворов. Следует избегать более длительного окрашивания, когда раствор становится темно-коричневым и в нем возникают пузырьки, так как оно приводит к образованию неравномерной окраски и загрязненного фона. Кроме того, другие хромосомные структуры, в частности кинетохоры, также имеют тенденцию к окрашиванию серебром, и это еще одна причина, по которой следует избегать избыточного окрашивания.
Несмотря на то что ядрышковые организаторы окрашиваются в черный цвет, при интерпретации результатов могут возникать трудности, поскольку весь остальной материал хромосом также слабо окрашивается. Контраст можно несколько увеличить, применяя светофильтры (разд. 6.1), однако часто бывает полезно окрасить хромосомы дополнительно. Если дополнительное окрашивание произведено с помощью дифференциального метода, можно точно выяснить, какие хромосомы несут ядрышковые организаторы.
Для дополнительного сплошного окрашивания можно воспользоваться 5%-ным раствором Гимза при рН 6,8. Результаты серебрения могут сильно различаться, поэтому длительность окрашивания нужно подобрать эмпирически. Важно не перекрасить препарат, чтобы не затруднить выявление ядрышковых организаторов.
Желательно получить окраску от светлого до умеренного пурпурно-красного цвета. В случае перекрашивания препарат следует отмыть от красителя Гимза в 70%-ном этаноле и вновь окрасить в течение более короткого времени. Простое дополнительное окрашивание особенно полезно в случае пахитенных хромосом, где границы хромосом трудно выявить после окраски одним серебром. Оно также может быть полезно для анализа митотических хромосом в тех случаях, когда их не требуется идентифицировать.
Чтобы можно было идентифицировать хромосомы, нужно перед окрашиванием ядрышковых организаторов провести G-, Q-, R- или С-окрашивание [28]. Наиболее успешно из всех перечисленных применяется Q-метод, поскольку остальные приводят к заметному ослаблению окрашивания серебром или,
в случае применения трипсина, даже к полной потере его. Как правило, лучшие результаты дает дифференциальное окрашивание, проведенное после серебрения, так как в этом случае оно не влияет на количество отложившегося на ядрышковых организаторах серебра. Кроме того, тогда нет необходимости фотографировать дифференциально окрашенные хромосомы до окраски серебром; если дифференциальное окрашивание проводится после серебрения, то и сегментацию, и отложение серебра можно видеть одновременно. Для этих целей подходят стандартные способы дифференциального окрашивания, но время обработки обычно требуется изменить (как правило, увеличить). Ховелл и Блэк [29] получили хорошие результаты, проводя после серебрения окрашивание по Гимза с обработкой трипсином или с помощью ASGметода, и неудовлетворительные результаты при использовании Q-метода. Последний метод может, однако, давать хорошие результаты, хотя способ одновременного наблюдения флуоресцирующих Q-сегментов и посеребренных ядрышковых организаторов менее распространен. Прежде чем остановиться на одной процедуре, важно опробовать различные методы дифференциального окрашивания в сочетании с методом серебрения ядрышковых организаторов. Не следует пытаться применять все разнообразные модификации, используемые в отдельных лабораториях, хотя нельзя указать какого-то метода, который всегда без модификаций давал бы хорошие результаты.
Помните, что при работе с растворами серебра следует соблюдать осторожность, поскольку они с неизбежностью окрасят в черный цвет все, на что попадут. Обычных приемов аккуратного обращения с реактивами будет достаточно, но лучше использовать дополнительно одноразовые перчатки и защитное покрытие для стола (например, выпускаемые фирмами Benchkote, Whatman Lab Sales).
201
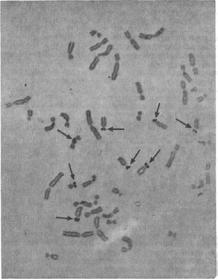
Рис. 9.6. Серебрение ядрышковых организаторов в метафазных хромосомах лимфоцита человека. Ядрышковые организаторы указаны стрелками. Обратите внимание на различия в их размерах. Дополнительное окрашивание по Гимза
5. Специальные методы дифференциального окрашивания
Методы, описываемые в настоящей главе, отличаются от так называемых «стандартных» методов, описанных в разд. 4, тем, что они менее распространены, или тем, что требуют использования специальных приемов при изготовлении хромосомных препаратов. Ниже описываются четыре метода: окраска ДАФИ/дистамицином, которая позволяет выявить подкласс гетерохроматиновых сегментов у некоторых видов животных; дифференциальное окрашивание, которое выявляет порядок репликации ДНК в различных сегментах хромосом; дифференциальное окрашивание с высоким разрешением, позволяющее получить значительно более детальную картину сегментации хромосом; иммуноцитохимическое выявление кинетохоров.
5.1. Окрашивание ДАФИ/дистамицином
Когда хромосомы, окрашенные флуорохромом ДАФИ, затем дополнительно окрашивают нефлуоресцирующим антибиотиком дистамицином, то наблюдается яркая флуоресценция только некоторых гетерохроматиновых сегментов из числа тех, которые выявляются с помощью С-окраски [30]. Сегменты, выявляемые с помощью ДАФИ/дистамицина, обнаружены в хромосомах некоторых (но не всех исследованных) млекопитающих и в хромосомах некоторых прямокрылых, но пока не отмечены в хромосомах растений. Окрашивание ДАФИ/дистамицином полезно проводить для более глубокого анализа гетерохроматиновых сегментов, выявляемых с помощью С-окраски. Его можно использовать для маркировки хромосом, которые содержат ДАФИ/дистамицин-позитивные сегменты в тех случаях, когда эти хромосомы претерпевают изменения.
1.Погрузите стекла с хромосомами в раствор дистамициыа А на 15 мин. Раствор состоит из 0,1—0,2 мг/мл дистамицинаА (Sigma), разведенного в фосфат-цитратном буфере Маклвейна (рН 7). Для приготовления буфера берут
82,5 мл 0,2 М Na2HPO4-2H2O (35,6 г/л),
17,5 мл 0,1 М лимонной кислоты (С6Н807-Н20, 21,01 г/л).
2.Быстро промойте стекла буфером Маклвейна, рН 7.
3.Погрузите стекла на 5—15 мин в раствор ДАФИ (0,2 или 4,0 мкг/мл ДАФИ в буфере Маклвейна, рН 7).
4.Промойте стекла буфером Маклвейна, рН 7.
5.Заключите препарат в тот же буфер. Промокните излишек жидкости, выступающей из-под покровного стекла, и промажьте стекло по краям резиновым клеем (разд. 4.4.1).
Результаты такого окрашивания хромосом человека представлены на рис. 9.7. Для получения наилучших результатов время окрашивания дистамицином и ДАФИ, а также концентрации красителей можно несколько изменить. Если окраска хромосом напоминает ту, которая получается после Q-окрашивания (распределение полос, которое получается при использовании одного только ДАФИ), то следует дольше красить дистамицином или брать его в более высокой концентрации. Если флуоресценция слишком слабая, нужно уменьшить время обработки дистамицином.
Свежеприготовленные хромосомные препараты, окрашенные ДАФИ/дистамицином, при наблюдении в УФсвете очень быстро выцветают. То же характерно для Q-окраски. Если однако, препараты после заключения подержать в холодильнике в течение суток или около того, то флуоресценция, как правило, становится более стабильной.
202
