
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
3.5. Список рекомендованої літератури
Фролов В.В. Химия. – М.: Высш. шк., 1986. – С.20-67.
Глинка Н.Л. Общая химия – Л.: Химия, 1988. – С.55-108; 2004. – С. 37-96.
Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С.7-40 (2001.– С.6 – 45).
Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 39-51.
Пилипенко А.Г., Починок В.Я., Середа И.П. и др.Справочник по елементарной химии. – Киев.: Наук. думка, 1985. – С. 50-93.
Сухан В.І., Табенська Т.В., Капустян А.Й., Горлач В.Ф. Посібник для вступників до вищих навч. закладів. – Київ.: Либідь, 1996. – С.53-85.
7. Кириченко В.І. Загальна хімія: Навч. посіб. – К.: Вища шк., 2005. – С. 21– 59.
Т е м а 4. Хімічний зв'язок. Комплексні сполуки
4.1. Рекомендації до вивчення теоретичного матеріалу
Вчення про хімічний зв’язок - центральна проблема сучасної хімії. Без знання природи взаємодії атомів неможливо зрозуміти причини різноманітності властивості хімічних речовин, яких налічується вже біля 20 мільйонів, уявити механізм їх утворення, їх склад, будову і реакційну здатність. Взаємодія атомів, яка приводить до утворення двох і багатоатомних систем - молекул, іонів, радикалів – зумовлена перекриванням їх електронних орбіталей, що супроводжується сполученням атомів в одне ціле хімічними зв’язками і змішенням повної енергії системи (молекули, іонів, радикалів).
Основні положення теорії хімічного зв'язку були сформульовані наприкінці 20-х – початку 30-х років ХХ століття (В. Гайтлер, Ф.Лондон – метод валентних зв'язків (ВЗ); Р. Маллікен – метод молекулярних орбіталей шляхом лінійної комбінації атомних орбіталей (МО ЛКАО). В даний час ці дві теорії хімічного зв'язку існують паралельно, доповнюючи одна одну. Відповідно до методу ВЗ, хімічний зв'язок утворюється за рахунок перекривання електронних хмар двох атомів з антипаралельними спінами з утворенням загальної електронної пари (ковалентний зв'язок) А+ВАВ. Відповідно до методу МО ЛКАО, зв'язок між двома атомами здійснюється за рахунок розміщення електронів на загальних молекулярних орбіталях (звязуючих чи розпушуючих).
Ковалентний зв’язок. Варто докладно ознайомитися з методом ВЗ як найбільш простим і найбільше використовуваним для пояснення будови молекул і властивості речовин, а також з характерними особливостями ковалентного зв’язку: насиченістю, напрямленістю, поляризованістю. Відповідно до методу ВЗ хімічний зв’язок зумовлюється перекриванням s-, p-, d-, f-орбіталей, які (крім s-орбіталі) мають напрямленість, а електронні хмари, крім того, відрізняються формою. Залежно від способу перекривання та симетрії електронної хмари утворюються σ-(сигма)-, π(пі)- і δ(дельта)- зв’язки (рис.2).
σ-зв’язок здійснюється при перекриванні електронних хмар(s-s, s-p, p-p, d-d тощо) вздовж лінії, яка з’єднує два ядра. Він завжди одинарний.
π-зв’язок виникає при перекриванні електронних хмар (p-p, d-d, p-d) по обидві боки від хмари, яка з’єднує ядра атомів.
δ- зв’язок утворюється при перекриванні усіх чотирьох пелюсток d-електронних хмар, розміщенних у паралельних площинах.
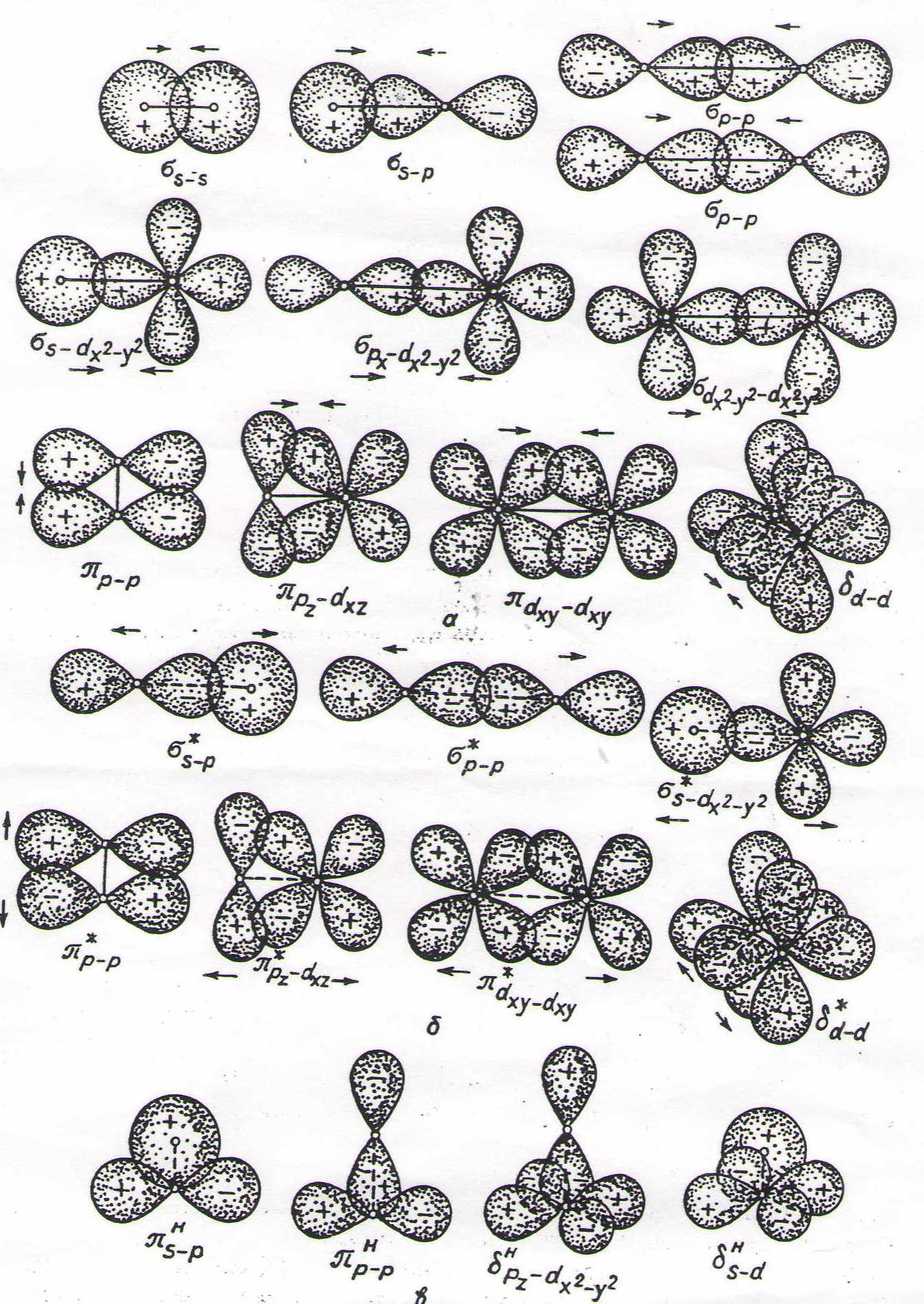
Рис. 2. Схема перекривання орбіталей при утворенні σ-, π - та δ-зв’язків: а – позитивне перекривання (зв’язування); б – негативне перекривання (розслаблення); в – індиферентне перекривання (незв’язування).
Якщо у взаємодіючих атомах немає (або не вистачає) неспарених електронів, то утворенню хімічного зв’язку передує процес розпарювання електронів (перехід атома у збуджений стан) з наступним усередненням орбіталей за формою й енергією (гібридизація атомних орбіталей). Наприклад:
4Be 1s22s22p0 + hν → 4Be* 1s22s12p1
У залежності від типу гібридизації молекулярні орбітали можуть мати різний напрямок у просторі: sp-гібридизація – лінійний (кут зв'язку дорівнює 1800); sp2- гібридизація – до вершин рівностороннього трикутника ( = 1200); sp3 – гібридизація – до вершин тетраедра ( = 109,50); sp3d – гібридизація – до вершин тригональної піраміди або тетрагональної піраміди; sp3d2 – гібридизація до вершин октаедра; sp2d – гібридизація – до вершин квадрата ( = 900). Крім того, що гібридні орбіталі беруть участь в утворенні -зв'язку, вони можуть нести на собі неподілені електронні пари, що в цілому визначає геометрію молекул.
До характеристик зв'язку відносяться:
- довжина зв'язку– оптимальна відстань між ядрами атомів (нм чи Å; 1 нм = 10-9м, 1 Å = 10-10м);
- енергія зв'язку– кількість енергії по модулю, що виділилася при утворенні звязку, (при утворенні зв'язку енергія виділяється, а при руйнуванні – поглинається) (кДж/моль);
- полярність зв'язку– визначається
наявністю на атомах часткового позитивного
і негативного зарядів, що приводять до
виникнення дипольного моменту![]() =lq(Д) (1 Дебай= 3,33∙10-30
Кл∙м),
деl-довжина
диполя, м;q– елементарний
заряд, рівний 1,60210-19Кл. Полярність зв'язкуслід
відризнятивідполярностімолекули,якавизначається як сума векторів дипольних
моментів усіх зв'язків у молекулі.
(Наприклад,
=lq(Д) (1 Дебай= 3,33∙10-30
Кл∙м),
деl-довжина
диполя, м;q– елементарний
заряд, рівний 1,60210-19Кл. Полярність зв'язкуслід
відризнятивідполярностімолекули,якавизначається як сума векторів дипольних
моментів усіх зв'язків у молекулі.
(Наприклад,![]() 0, тому що
0, тому що![]() = 3,0-2,2, але
= 3,0-2,2, але![]() =
=![]() = 0 Д).
= 0 Д).
У залежності від полярності зв'язку можна охарактеризувати три різних випадки:
1. Очевидно, якщо А = В, на атомах не створюються часткові заряди, це відповідає виникненню між ними ковалентного неполярногозв'язку (загальні електрони не зміщені ні до одного з атомів).
2. Якщо АВ, електрони зміщені до більш електронегативного атома, на останніх виникають часткові зарядиq< 0,5, що приводять до утворенняковалентного полярного зв'язку.
3. Якщо q> 0,5, то вважається, що електрони належать практично цілком одному з атомів; утворюється катіон і аніон, між якими здійснюється електростатичне притягання –іоннийзв'язок.
Необхідно пам'ятати, що чисто ковалентного і чисто іонного зв'язків не існує. У випадку q= 0,5 реалізується приблизно 75% іонного типу зв'язку.
Донорно-акцепторний зв’язок. Комплексні сполуки. Необхідно особливу увагу приділити донорно-акцепторному механізму утворення ковалентного зв'язку, суть якого полягає в постачанні готової пари електронів (неподіленої пари) одним атомом (донором) на вакантну орбіталь іншого атома (акцептора) і утворенні загальної електронної пари:D+ADA. Завдяки донорно-акцепторній взаємодії вдається стабілізувати негативний ступінь окиснення металів:
Na3[![]() (NO)3CO],
Na[
(NO)3CO],
Na[![]() (CO)5],
Na[
(CO)5],
Na[![]() (СО)6].
(СО)6].
Сполуки, у яких реалізується донорно-акцепторний механізм ковалентного зв’язку, називаються комплексними, або координаційними сполуками («сполуки у квадратних дужках»). У становленні координаційної хімії виділяють три етапи: перший пов’язаний з публікацією у 1893 р. А.Вернером основних положень теорії координаційних сполук; другий (приблизно від середини ХХ ст.) – з синтезом і виявленням будови комплексів металів з різноманітними органічними сполуками; третій (останні два десятиліття) -пов’язаний з дослідженнями комплексоутворення на поверхні на нанорівні («нанотехнологія») і синтезом супрамолекулярних сполук («супромолекулярна координаційна хімія»). Корисно ознайомитись з сучасним станом хімії комплексних сполук і її значенням для техніки і промисловості у навчальному посібнику: В.В.Скопенко, А.Ю.Цивадзе, Л.И.Савранский, А.Д.Гарновский «Координационная химия» - М.: ИКЦ «Академкнига», 2007 - 487с.
У підручниках для інженерних спеціальностей ця тема розглядається в основному на рівні першого (вернеровського) етапу. Слід звернути увагу на наступне.
1. У більшості координаційних сполук розрізняють внутрішню і зовнішню сфери, які мають протилежні заряди. Наприклад, у комплексах цинку: а) Na2[Zn(OH)4] i б) [Zn(NH3)4]Cl2 внутрішніми сферами є Zn(OH)4]2- i [Zn(NH3)4]2+, а зовнішніми - іони Na+ i Cl- відповідно. Іон Zn2+ (акцептор) для утворення комплексних іонів поставляє одну 4s-iтри 4 р-орбіталі. Іони ОН- і молекули NH3 називаються лігандами (донори електронних пар). У кожному комплексі навколо ц.а. координовані по 4 ліганди, тобто координаційне число іону Zn2+ дорівнює чотирьом.
Внутрішня сфера не завжди має заряд. Наприклад, у різнолігандному комплексі [Pt(NH3)2Cl4] заряд відсутній (дорівнює нулю).
2. Атомні орбіталі центрального атому гібридизуються (наприклад, у Zn2+ sp3-гібридизація), що приводить до зміцнення донорно-акцепторного зв’язку, а для комплексів з однаковими лігандами - до утворення симетричних структур (тетраедрів, октаедрів тощо). При розчинені у воді комплекси легко дисоціюють на внутрішню і зовнішню сферу (іонний характер зв’язку). Це первинна дисоціація, вона відбувається по типу дисоціації сильних електролітів. Комплексні іони також дисоціюють на іон-комплексоутворювач і ліганди. Наприклад, [Zn(OH)4]2- ↔ Zn2+ + 4OH- . Але це вторинна, незначна дисоціація, рівновага зміщена вліво. Константа цієї рівноваги називається константою нестійкості (Кн) . Для іона [Zn(OH)4]2- Кн має вираз і значення:
![]()
Константа нестійкості є мірою стійкості комплексів: чим менше константа, тим більш стійкою є комплексна сполука. З цієї точки зору подвійні солі, наприклад, (NH4)2Fe(SO4)2, KMgCl3 і інші не є комплексами, тому що дисоціюють у водному розчині в одну стадію, як сильні електроліти.
При складанні рівнянь обміну за участю комплексних сполук майте на увазі, що комплексні іони, як правило, не руйнуються, а переходять цілком з однієї сполуки в іншу. Наприклад:
2K3[Fe(CN)6]+3CuSO4Cu3[Fe(CN)6]2+3K2SO4;
2[Fe(CN)6]3-+3Cu2+Cu3[Fe(CN)6]2.
Для пояснення магнітного, спектральних і ряду інших властивостей комплексних сполук у даний час використовується теорія кристалічного поля, з основними положеннями якої можна ознайомитися по підручнику і задачнику М.Л. Глінки.
