
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
21.5. Список рекомендованої літератури
Ахметов Н .С. Общая и неорганическая химия . –М.: Высш. шк..,2001. с 588 – 597
Кириченко В. І. Загальна хімія. – К.: Вища шк.,2005.-с. 439 – 449
Слободяник М. С., Улько Н. В., Бойко К. М., Самойленко В. М. Загальна та неорганічна хімія : Практикум. – К.: Либідь, 2004. – с. 208 – 215
Михайленко Я. И. Курс общей и неорганической химии. – М.: Высш. шк., 1966.- с. 303 – 317
Глинка Н. Л. Общая химия – Л.:Химия, 1988
Т е м а 22. Властивості р-металів IVВ групи – Sn, Pb
22.1. Рекомендації до вивчення теоретичного матеріалу
Станум і плюмбум відносять до сімейства р-елементів, загальна електронна формула: ns2np2, де n – номер періоду. Отже, для цих металів: Sn –5s25p2, для Pb –6s26p2. Практично для всіх s, p -елементів можливі ступені окиснення можуть бути визначені на підставі розподілу валентних електронів по квантових комірках у нормальному і збудженому стані. Для елементів підгрупи Ge:
у нормальному стані в збудженому стані
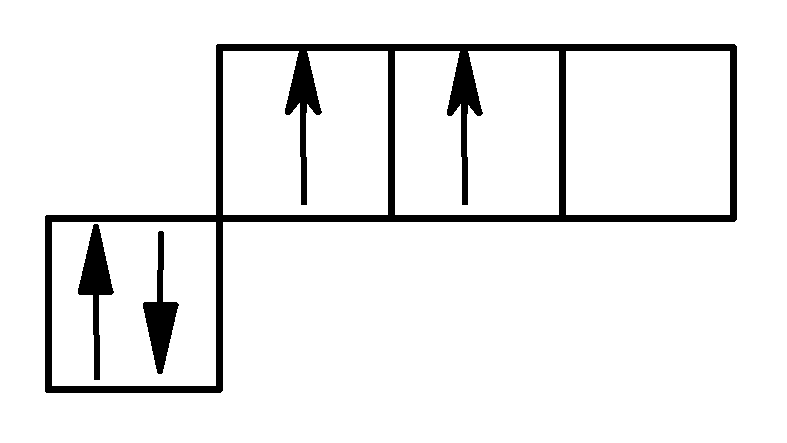

2 валентних електрони 4 валентних електрони
Таким чином, станум і плюмбум у сполуках можуть виявляти ступені окиснення 0;+2; +4.
При визначенні кислотно-основних властивостей оксидів і гідроксидів станума і плюмбума в ступенях окиснення +2 і +4 необхідно пам'ятати, що вони є проміжними металами V і VI періодів, отже, їхні оксиди і гідроксиди в цих ступенях окиснення амфотерні. Причому:
ослаблення кислотних властивостей
 SnO
PbO SnO2
PbO2
SnO
PbO SnO2
PbO2
Sn(OH)2 Pb(OH)2 H2SnO3 H2PbO3
 посилення
основних властивостей
посилення
основних властивостей
Внаслідок
амфотерності гідроксидів Sn(OH)2
і Pb(OH)2
метали олово і свинець легко розчиняються
у водних розчинах лугів з утворенням
водню і комплексної солі:
![]() .
Взаємодія цих металів з розведеними
кислотами супроводжується окисненням
станума і плюмбума до ступеня окиснення
+2 і утворенням відповідних солей. Реакції
протікають при нагріванні. Усі ці реакції
гетерогенні, тому неодмінною умовою
їхнього протікання є розчинність солей,
що утворюються. З трьох солей PbCl2,
PbSO4,
Pb(NO3)2
розчинний тільки нітрат, тому свинець
краще розчиняється в HNO3:
.
Взаємодія цих металів з розведеними
кислотами супроводжується окисненням
станума і плюмбума до ступеня окиснення
+2 і утворенням відповідних солей. Реакції
протікають при нагріванні. Усі ці реакції
гетерогенні, тому неодмінною умовою
їхнього протікання є розчинність солей,
що утворюються. З трьох солей PbCl2,
PbSO4,
Pb(NO3)2
розчинний тільки нітрат, тому свинець
краще розчиняється в HNO3:
![]()

![]() -2e
Pb2+
3
-2e
Pb2+
3
NO3-
+4H+
+3e![]() 2
2
При
взаємодії з концентрованими кислотами
свинець у всіх випадках окиснюється до
Pb (2+), і утворює з концентрованою H2SO4
кислу сіль – Pb(HSO4)2.
C концентрованими сірчаною й азотною
кислотами олово окиснюється до ступеня
окиснення +4. Причому, при взаємодії з
концентрованою азотною кислотою
утворюється не сіль, а -олов'яна
кислота:
![]() .
Ця кислота не розчиняється ні в
кислотах, ні в лугах.
.
Ця кислота не розчиняється ні в
кислотах, ні в лугах.
Окисно-відновні властивості сполук Sn і Pb обумовлені різною стійкістю їхніх сполук у різних ступенях окиснення. У ступені окиснення +4 вони можуть бути тільки окисниками (оскільки ступінь окиснення +4 максимальна). Причому ця властивість яскравіше виражена в сполук Pb+4, тому що для плюмбуму більш стійкими є сполуки в ступені окиснення +2. У ступені окиснення +2 сполуки цих елементів виявляють як окисні, так і відновні властивості, але, з огляду на велику стійкість сполук Sn (4+), більш характерний перехід Sn2+ - 2e Sn+4, тобто прояв Sn (2+) відновних властивостей.
Завдяки наявності вакантних d-орбіталей, ці метали утворюють численні тетраедричні й октаедричні комплекси. Наприклад, гідроксокомплекси: Na2[Sn(OH)4], Na2[Sn(OH)6], K4[Pb(OH)6].
