
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
13.2. Приклади рішення типових задач
Задача 1. Електричний струм силою 6 А пропускали через водний розчин натрійм нітрату протягом 1,5 години. Написати рівняння процесів, що відбуваються при електролізі з інертним анодом. Які речовини й у якій кількості виділяються на електродах?
Розв’язок. У водному розчині натрій нітрат дисоціює за схемою: NaNO3Na+ + NO3-
К (-) А (+)
Na+, H2O NO3-, H2O
Стандартний електродний потенціал системи Na+ + e Na0 дорівнює (-2,71 В). Стандартний електродний потенціал відновлення води (-0,41 В). Тому на катоді буде відбуватися електрохімічне відновлення води, що супроводжується виділенням водню: 2Н2О + 2е Н2 + 2ОН-, а іони Na+ і ОН- будуть накопичуватися в катодному просторі. На аноді буде відбуватися електрохімічне окиснення води, що приводить до виділення кисню: 2Н2О –4е О2 + 4Н+, а іони NO3-, Н+ будуть накопичуватися в анодному просторі. Таким чином, одночасно з виділенням водню і кисню при електролізі водного розчину натрій нітрату утворюється натрій гідроксид (у катодному просторі) і азотна кислота (в анодному просторі), якщо між катодом і анодом розташована діафрагма.
Сумарне
рівняння: 4NaNO3
+ 6Н2О
![]() 2Н2
+ О2
+ 4NaOH + 4HNO3
2Н2
+ О2
+ 4NaOH + 4HNO3
Обчислимо кількість в кисню і водню по першому законі Фарадея:
V
=
![]() .
Оскільки при нормальних умовах
еквівалентний обєм
водню дорівнює 11,2 л, кисню – 5,6 л, а
.
Оскільки при нормальних умовах
еквівалентний обєм
водню дорівнює 11,2 л, кисню – 5,6 л, а
![]() = 1,5 години, то одержуємо:
= 1,5 години, то одержуємо:
V![]() =
=![]() = 3,76 л; V
= 3,76 л; V![]() =
=![]() =
1,88 л
=
1,88 л
Задача 2. При електролізі розчину купрум сульфату на аноді виділилося 168 см3 кисню при н.у. Скільки грамів міді виділилося на катоді?
Розв’язок.
Використовуючи закон
еквівалентів, запишемо:
![]() .
.
Отже,
маса міді : mCu
=
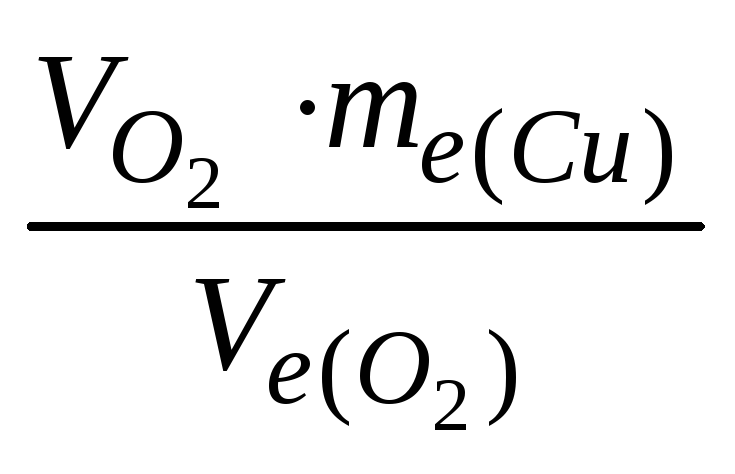 =
=![]() = 0,96 г. (Обєм
кисню виражаємо в системі СІ: 168 см3
= 168 мл = 0,168 л).
= 0,96 г. (Обєм
кисню виражаємо в системі СІ: 168 см3
= 168 мл = 0,168 л).
Задача 3. Електричний струм силою 2,5 А, проходячи через розчин електроліту, за 30 хвилин виділяє з розчину 2,77 г двовалентногоого металу. Визначите, який це метал.
Розв’язок.
Використовуючи закон
Фарадея (m![]() =
=![]() ),
розрахуємо еквівалентну масу цього
металу по формулі:
),
розрахуємо еквівалентну масу цього
металу по формулі:
m![]() =
=![]() ;
m
;
m![]() =
=![]() г/моль. Еквівалентна маса пов'язана з
атомною масою співвідношенням: m
г/моль. Еквівалентна маса пов'язана з
атомною масою співвідношенням: m![]() =
=![]() ,
з якого випливає:АМе
= m
,
з якого випливає:АМе
= m![]() у
= 59,42
= 118,5 г/моль. Даний метал – олово (Sn).
у
= 59,42
= 118,5 г/моль. Даний метал – олово (Sn).
13.3. Задачі для самостійного рішення 689, 690, 695, 709
13.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: прилад для електролізу: U-образна скляна трубка, электролізер (для проведення НДРС), графітовий і мідний електроди, випрямляч, розчини: сірчаної кислоти, хлориду олова (2+), іодиду калію, сульфату натрію, складні (рецептурні) розчини (див. дослід 5).
Дослід 1. Електроліз розчину сірчаної кислоти з мідним (активним) анодом
Наливають у U-образну трубку 1 М розчин сірчаної кислоти. Опускають вугільний і мідний електроди в розчин Н2SO4. Вугільний електрод з'єднують з катодом, а мідний – з анодом джерела струму (випрямляча).
Пропускають через розчин електричний струм протягом 8 – 10 хвилин з напругою 8 – 10 В.
Спостерігають за процесом, що протікає на катоді. Відзначають, що на початку досліду на катоді виділяється водень, потім, у міру забарвлення розчину в блакитний колір, катод покривається шаром міді.
Записують рівняння катодного й анодного процесів, що протікають при електролізі розчину сірчаної кислоти.
У висновках укажіть:
- У чому причина забарвлення розчину в блакитний колір?
- Чому швидкість виділення водню згодом зменшується, а на катоді починає осаджуватися мідь?
- Запропонуйте методику електролітичного очищення (рафінування «чорнової» міді).
Дослід 2. Електроліз розчину хлориду олова (2+)
Заповнюють електролизер розчином хлориду олова (2+). В обидва коліна електролізера опускають вугільні електроди, з'єднують електроди з джерелом постійного струму. Через 1-2 хвилини на вугільному катоді спостерігають появу блискучих кристаликів металевого олова.
З метою виявлення вільного хлору після закінчення досліду додають в анодний простір 3-4 краплі розчину іодиду калію і такий же обєм розчину крохмалю. Для цього попередньо відключають струм, анод виймають з електролізера і промивають водою. Спостерігають появу синього забарвлення.
Записують рівняння катодного й анодного процесів, що протікають при електролізі розчину хлориду олова (2+), а також сумарне рівняння.
У висновках укажіть:
- Яка речовина накопичується в розчині катодного простору; як довести її присутність?
- Чим обумовлене посиніння розчину в анодному просторі?
Дослід 3. Електроліз розчину йодиду калію
Наливають у електролізер розчин йодиду калію.
Опускають в оба коліна електролізера вугільні електроди, підключають їх до джерела постійного струму. На катоді спостерігають виділення газу. Через 4-5 хвилин відключають струм, виймають електроди і додають у катодний простір 2-4 краплі розчину фенолфталеїна.
З анодного простору відбирають піпеткою 2-3 краплі розчину, переносять їх у пробірку і розбавляють дистильованою водою до слабо-жовтого кольору. У пробірку додають 1-2 краплі розчину крохмалю.
Записують спостереження, складають схему електролізу і рівняння реакцій, що протікають на електродах.
У висновках укажіть:
- Чому на катоді не виділяється металевий калій?
- Поява яких іонів обумовила забарвлення в червоний колір розчину в катодному просторі?
- Що відбулося з йодид-іонами на аноді і чим обумовлене посиніння розчину анодного простору?
Дослід 4. Електроліз розчину сульфату натрію
Наливають у електролізер розчин сульфату натрію. Опускають в оба коліна електролізера вугільні електроди, підключають їх до джерела постійного струму.
Спостерігають виділення газу на катоді й аноді. Через 5 – 7 хвилин відключають електролізер, виймають електроди і додають по 2 – 3 краплі розчину лакмусу в обидва відростки електролізера.
Записують спостереження, складають схему електролізу і рівняння реакцій, що протікають на електродах.
У висновках укажіть:
- Який газ виділявся на катоді і на аноді?
- Які іони обумовили забарвлення лакмусу в катодному просторі в синій колір, а в анодному просторі в червоний колір?
- Яка роль Na2SO4 у процесі електролізу розчину даної солі?
- Запропонуйте інші солі, електроліз водних розчинів яких проходив би аналогічно.
Дослід 5. Нанесення гальванопокриттів (елементи НДРС)
Загальні вказівки
Гальванічними називають металеві покриття, нанесені на поверхню виробу методом електролізу. Нанесення гальванопокриттів проводять з метою додання виробу красивого зовнішнього вигляду, корозійній стійкості підвищеній твердості поверхневого шару. Найбільш широко в промисловості використовують покриття нікелем (нікелювання), цинком (цинкування), оловом (лудіння), хромом (хромування), міддю (мідніння) і ін.
Для гальванотехніки використовується низька напруга в межах 2 – 12 В і великий струм (до 100 А й більш). Для дрібних деталей у лабораторних умовах часто досить батареї чи акумуляторів звичайного випрямляча струму. Електричний струм регулюють реостатами в анодному ланцюзі (позитивний полюс). Туди ж включається й амперметр для його виміру. Нанесення металевих покрить виконується в спеціальних ваннах чи судинах. Невеликі деталі можна покривати в скляних і керамічних склянках або ванночках.
Для одержання високоякісного покриття деталі попередньо повинні бути добре очищені від усіх нашарувань. Це виконується механічно (шліфуванням, щіткою) чи хімічно (травлення, видалення іржі). Потім поверхню перед зануренням в електроліт необхідно ретельно знежирити (хімічно чи електричним шляхом) і промити проточною водою.
Розчини, що використовуються для гальванопокриттів, як правило, багатокомпонентні і містять, крім солі металу, що осаджується, різні домішкки, що збільшують електропровідність розчинів (найчастіше сульфат натрію), активують анодні процеси (хлорид натрію чи амонію), коректують рН розчинів (борна кислота) і ін. Розробкою таких складів займаються цілі наукові лабораторії і колективи. Тому завжди необхідно чітко і строго дотримувати інструкції і режиму електролізу при виконанні робіт з електролітичного осадження металів.
Корисним посібником для ознайомлення з основами електротехніки є книга: Шкержик Я. Рецептурный справочник для электротехника. – М.: Энергоиздат, 1989. – 142 с.
Хід роботи:
Заповнюють електролітичні ванни відповідними складними розчинами (табл. 9).
Т а б л и ц я 9
Склад розчинів для електролітичного осадження металів
|
Варіант |
Складний розчин |
Аноди |
|
1 |
ZnSO47H2O – 300 г/л |
Цинковий |
|
Al2(SO4)3 – 30 г/л | ||
|
Na2SO410H2O – 50 г/л | ||
|
КAl(SO4)212H2O – 50 г/л | ||
|
2 |
NiSO47H2O – 300 г/л |
Нікелевий |
|
Na2SO410H2O – 100 г/л | ||
|
NaCl –10 г/л | ||
|
Н3PO4 - 30 г/л |
