
- •Введение Общие рекомендации для подготовки к лабораторным занятиям
- •Лабораторная работа №_____ Тема:________________________________________________
- •Неметалл
- •Классификация бинарных соединений
- •Классификация оксидов по составу
- •1.2.2. Трехэлементные соединения с кислородом и водородом (гидроксисоединения)
- •Классификация гидроксисоединений и их производных – солей
- •Список традиционных названий оксокислот и солей Таблица 4
- •2.Классификация веществ по типу химической связи и физическим свойствам
- •Классификация кристаллов по типу химической связи
- •5. Классификация неорганических веществ по кислотно-основным свойствам
- •5.1. По кислотно-основным свойствам неорганические соединения подразделяют:
- •Основание
- •Кислота
- •Амфотерное соединение
- •Кислота Основание Основание Кислота
- •5.2. Взаимодействие оксидов и гидроксисоединений с водой
- •5.3. Реакция нейтрализации
- •Например:
- •5.3.4. Закономерности изменения кислотно-основных свойств оксидов
- •Сравнительная характеристика свойств оксидов металлов и неметаллов
- •Генетическая связь между классами неорганических соединений
- •5.4. Гидролиз солей
- •Факторы, влияющие на гидролиз соли
- •6.Основные способы получения оксидов и гидроксидов
- •6.1. Способы получения оксидов
- •6.2. Способы получения гидроксидов
- •7. Лабораторные работы по теме:
- •7.1. Лабораторная работа № 1.
- •Задание 1.4.23 Сумма коэффициентов в молекулярном уравнении реакции
- •7.2. Лабораторная работа № 2.
- •7.3. Лабораторная работа № 3
- •7.4. Лабораторная работа № 4
- •8. Окислительно-восстановительные процессы
- •8.3. Химические свойства металлов
- •8.3.1. Ряд стандартных окислительно-восстановительных потенциалов металлов
- •8.3.2. Взаимодействие металлов с водой
- •8.3.3. Взаимодействие металлов с водными растворами щелочей
- •8.3.4. Взаимодействие металлов с растворами кислот, окисляющими
- •8.3.5. Взаимодействие металлов с концентрированной серной кислотой
- •8.3.6. Взаимодействие металлов с азотной кислотой
- •8.4. Лабораторная работа № 5
- •9.1. Основные понятия
- •Сравнение процессов в гальванических элементах и электролиза
- •9.2. Гальванический элемент
- •I процесс (коррозия с водородной деполяризацией)
- •II процесс (коррозия с кислородной деполяризацией)
- •9.4. Электролиз
- •Электролиз растворов солей
- •Электролиз водного раствора сульфата меди (II) с инертным анодом
- •Ряд разряжаемости катионов на катоде
- •Ряд разряжаемости анионов на аноде
- •9.5. Лабораторная работа № 6
- •Приложение
- •Константы диссоциации некоторых кислот и оснований при 25оС
- •Произведение растворимости некоторых малорастворимых электролитов при 25оС
- •Стандартные окислительно-восстановительные потенциалы в водных растворах при 25оС
- •Библиографический список
- •Содержание
Электролиз растворов солей
В растворах солей, помимо гидратированных катионов и анионов электролита, присутствует растворитель – вода, которая может проявлять свойства окислителя за счет водорода в степени окисления +1 либо восстановителя за счет кислорода в степени окисления –2.
Н2О – окислитель
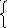
2Н+ + 2е![]() Н2(рН<7)
Н2(рН<7)
2Н2О + 2е![]() Н2 + 2ОН-(рН≥7)
Н2 + 2ОН-(рН≥7)
![]()
Окислительно-восстановительный потенциал «водородного электрода» зависит от рН
рН=0
![]()
рН=7
![]()
рН=14
![]()
Н2О – восстановитель
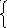
2Н2О – 4е![]() О2 + 4Н+(рН≤7)
О2 + 4Н+(рН≤7)
4ОН– – 4е![]() О2 + 2Н2О (рН>7)
О2 + 2Н2О (рН>7)
![]()
Окислительно-восстановительный потенциал «кислородного электрода» зависит от рН
рН=0
![]()
рН=7
![]()
рН=14
![]()
Если в растворе электролита присутствует несколько возможных окислителей и несколько возможных восстановителей, осуществляется тот процесс, который характеризуется наименьшим потенциалом разложения. То есть на катоде восстанавливается окислитель с наибольшим суммарным значением окислительно-восстановительного потенциала и перенапряжения, а на аноде окисляется восстановитель с наименьшим суммарным значением окислительно-восстановительного потенциала и перенапряжения.
Электролиз водного раствора иодида натрия
В растворе осуществляются процессы диссоциации
![]()
![]()
Иодид натрия гидролизу не подвергается, следовательно, среда в растворе нейтральная и рН=7. Положительно заряженные ионы перемещаются к отрицательно заряженному электроду – катоду. Возможные окислители (Na+иH+) характеризуются следующими значениями окислительно-восстановительных потенциалов
![]() >
>![]()
Следовательно, более сильным окислителем является ион Н+и на катоде осуществляется процесс восстановления воды до молекулярного водорода
к атодная
2H2O+ 2e→H2
+ 2OH–1
атодная
2H2O+ 2e→H2
+ 2OH–1
реакция
Отрицательно заряженные ионы перемещаются к положительно заряженному электроду-аноду. Сравним значения окислительно-восстановительных потенциалов возможных восстановителей (I–иOH–)
![]() <
<![]()
Более сильным восстановителем является иодид-ион и на аноде осуществляется процесс окисления I––ионов доI2:
|
анодная |
2I– – 2e → I2 |
1 |
|
реакция |
Составим суммарное уравнение реакции, объединив уравнения катодной и анодной реакций с учетом коэффициентов электронного баланса
2H2O+ 2I–
![]() H2 + 2OH–
+I2(краткое
ионное уравнение)
H2 + 2OH–
+I2(краткое
ионное уравнение)
2H2O+ 2KI
![]() H2
+ 2KOH+I2(ан.)(молекулярное
уравнение)
H2
+ 2KOH+I2(ан.)(молекулярное
уравнение)
Электролиз водного раствора сульфата меди (II) с инертным анодом
В растворе протекают следующие процессы:
уравнение
диссоциации CuSO4
![]() Cu2+ +SO42-
Cu2+ +SO42-
уравнение
гидролиза Cu2+
+H2O![]() CuOH+ +H+;
(рН<7)
CuOH+ +H+;
(рН<7)
уравнение
диссоциации Н2О![]() Н+ + ОН–
Н+ + ОН–
Возможные окислители Cu2+иH+ ( изH2O)
Так
как
![]() >
>![]() ,
более сильным окислителем является
ионCu2+, и на катоде
происходит осаждение металлической
меди.
,
более сильным окислителем является
ионCu2+, и на катоде
происходит осаждение металлической
меди.
-
катодная
Cu2++ 2e→Cuo
2
реакция
Возможные восстановители SO42-иH2O.
Так
как
![]() <
<![]() ,
более сильным восстановителем является
вода, и на аноде происходит выделение
кислорода из воды
,
более сильным восстановителем является
вода, и на аноде происходит выделение
кислорода из воды
-
анодная
2Н2О – 4e→ О2 + 4Н+
1
реакция
Составим суммарное уравнение реакции, объединив уравнения катодной и анодной реакций с учетом коэффициентов электронного баланса.
2Cu2+ + 2H2O![]() 2Cuo(кат.)
+O2(ан.) +
4Н+(ан.)(краткое
ионное уравнение)
2Cuo(кат.)
+O2(ан.) +
4Н+(ан.)(краткое
ионное уравнение)
2CuSO4 + 2H2O → 2Cu(кат.) + O2(ан.) + 2H2SO4(ан.) (молекулярное уравнение)
