
- •С.В. Свергузова, ж.А. Сапронова Введение в гидрологию
- •С.В. Свергузова, ж.А. Сапронова Введение в гидрологию
- •Оглавление
- •Предисловие
- •Введение
- •1. Общие сведения о воде и гидрологии
- •1.1. Вода в природе и жизни человека
- •1.2. Водные объекты. Понятие о гидросфере
- •1.3. Гидрологический режим и гидрологические процессы
- •1.4. Науки о природных водах
- •1.5. Методы гидрологических исследований
- •1.6. Использование природных вод и практическое значение гидрологии
- •Водопотребление в мире и некоторых странах
- •1.7. Водное законодательство в России
- •1.8. Практическое значение гидрологии
- •2. Химические и физические свойства природных вод
- •2.1. Вода как вещество, ее молекулярная структура и изотопный состав
- •2.2. Химические свойства воды. Вода как растворитель
- •2.3. Физические свойства воды
- •2.3.1. Агрегатные состояния воды и фазовые переходы
- •2.3.2. Плотность воды
- •2.3.3. Тепловые свойства воды
- •2.3.4. Некоторые другие физические свойства воды
- •3. Физические основы гидрологических процессов
- •3.1. Фундаментальные законы физики и их использование при изучении водных объектов
- •3.2. Водный баланс
- •3.3. Основные закономерности движения природных вод
- •3.3.1. Классификация видов движения воды
- •3.3.2. Расход, энергия, работа и мощность водных потоков
- •4. Круговорот воды в природе и водные ресурсы земли
- •4.1. Вода на земном шаре
- •4.2. Современные и ожидаемые изменения климата и гидросферы земли
- •4.3. Круговорот теплоты на земном шаре и роль в нем природных вод
- •4.4. Круговорот воды на земном шаре
- •4.5. Круговорот содержащихся в воде веществ
- •4.6. Влияние гидрологических процессов на природные условия
- •4.7. Водные ресурсы земного шара, частей света и России
- •5. Гидрология ледников
- •5.1. Происхождение ледников и их распространение на земном шаре
- •5.2. Типы ледников
- •5.3. Образование и строение ледников
- •5.4. Режим и движение ледников
- •5.5. Роль ледников в питании и режиме рек. Практическое значение горных ледников
- •6. Гидрология подземных вод
- •6.1. Происхождение подземных вод
- •6.2. Физические и водные свойства грунтов. Виды воды в порах грунтов
- •6.2.1. Физические свойства грунтов
- •Пористость грунтов.
- •6.2.2. Виды воды в порах грунта
- •6.2.3. Водные свойства грунтов
- •6.3. Классификация подземных вод. Типы подземных вод по характеру залегания
- •6.3.1. Классификации подземных вод
- •6.3.2. Воды зоны аэрации. Почвенные воды, верховодка, капиллярная зона
- •6.3.3. Воды зоны насыщения. Грунтовые воды
- •6.3.4. Артезианские и глубинные воды
- •6.4. Движение подземных вод
- •6.5. Водный баланс и режим подземных вод
- •6.6. Взаимодействие поверхностных и подземных вод. Роль подземных вод в питании рек. Некоторые природные проявления подземных вод
- •7. Гидрология рек
- •7.1. Реки и их распространение на земном шаре
- •Важнейшие реки Росии и зарубежного мира
- •7.2. Типы рек
- •7.3. Морфология и морфометрия реки и ее бассейна
- •7.3.1. Водосбор и бассейн реки
- •7.3.2. Морфометрические характеристики бассейна реки
- •7.3.3. Физико-географические и геологические характеристики бассейна реки
- •7.3.4. Река и речная сеть
- •7.3.5. Долина и русло реки
- •7.3.6. Продольный профиль реки
- •7.4. Питание рек
- •7.5. Водный режим рек
- •7.5.1. Виды колебаний водности рек
- •7.5.2. Фазы водного режима рек. Половодье, паводки, межень
- •7.6. Речной сток и его составляющие
- •7.7. Движение воды в реках. Распределение скоростей течения в речном потоке
- •7.8. Русловые процессы
- •7.8.1. Физические причины и типизация русловых процессов
- •7.8.2. Устойчивость речного русла
- •7.9. Термический и ледовый режим рек
- •7.9.1. Термический режим рек
- •7.9.2. Ледовые явления
- •7.10. Основные черты гидрохимического и гидробиологического режима рек
- •7.10.1. Гидрохимический режим рек
- •7.10.2. Гидробиологические особенности рек
- •8. Гидрология озер
- •8.1. Озера и их распространение на земном шаре
- •8.2. Типы озер
- •8.3. Ледовые явления на озерах
- •8.4. Основные особенности гидрохимических и гидробиологических условий. Донные отложения озер
- •8.4.1. Гидрохимические характеристики озер
- •8.4.2. Гидробиологические характеристики озер
- •9. Гидрология болот
- •9.1. Происхождение болот и их распространение на земном шаре
- •9.2. Типы болот
- •9.3. Строение, морфология и гидрография торфяных болот
- •9.4. Водный баланс и гидрологический режим болот
- •9.5. Влияние болот и их осушения на речной сток. Практическое значение болот
- •Библиографический список
- •Введение в гидрологию
- •308012, Г. Белгород, ул. Костюкова, 46.
2.1. Вода как вещество, ее молекулярная структура и изотопный состав
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине (рис. 1).
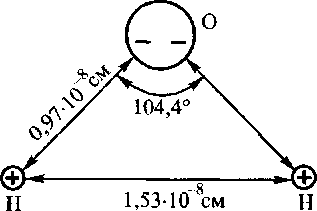
Рис. l. Строение молекулы воды
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд. В свою очередь, оба атома водорода, лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь.
Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды – величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнению с силами их взаимодействия в вакууме. Высокая диэлектрическая проницаемость воды предопределяет большую ее ионизирующую способность, т.е. способность расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Каждая молекула воды, обладающая двумя положительными и двумя отрицательными зарядами, способна образовать четыре так называемые водородные связи, т.е. соединения положительно заряженного ядра водорода (протона), химически связанного в одной молекуле, с отрицательно заряженным атомом кислорода, принадлежащим другой молекуле.
Наиболее упрощенное представление о молекулярной структуре воды заключается в следующем. Водяной пар состоит преимущественно из мономерных (одиночных) молекул воды, т.е. водородные связи практически не реализуются. В твердом состоянии (лед) строение воды в высокой степени упорядочено. В кристаллах льда молекулы воды составляют гексагональную систему с прочными водородными связями. Такая структура весьма рыхлая и, как иногда говорят, "ажурная". Вода в жидком состоянии занимает промежуточное положение между паром и льдом. В такой воде сохраняются элементы "льдоподобного" молекулярного каркаса, а его пустоты частично заполняются одиночными молекулами. Поэтому "упаковка" молекул в воде, находящейся в жидком состоянии, более плотная, чем у льда, и плавление льда приводит не к уменьшению, а к "аномальному" увеличению плотности воды.
Переход от полностью упорядоченной рыхлой молекулярной структуры, свойственной льду, к более плотной структуре, свойственной воде в жидком состоянии, не происходит мгновенно в процессе плавления льда, а продолжается и в жидкой воде. При повышении температуры наряду с упомянутым уплотнением "упаковки" молекул происходит и свойственное всем веществам увеличение объема воды вследствие роста интенсивности теплового движения молекул. В диапазоне повышения температуры от 0 до 4 °С преобладает процесс уплотнения химически чистой воды, при температуре выше 4 °С – тепловое расширение, поэтому вода обладает "аномальным" свойством – наибольшей плотностью не при температуре плавления, а при 4 °С.
Присущие воде водородные связи примерно в десять раз прочнее связей, обусловленных межмолекулярными взаимодействиями, которые характерны для большинства других жидкостей. Поэтому для преодоления этих связей при плавлении, нагревании и испарении воды необходимо гораздо больше энергии, чем в случае других жидкостей. Это определят ряд "аномалий" тепловых свойств воды.
Водород и кислород имеют несколько природных изотопов: 1Н ("обычный" водород), 2Н, или D ("тяжелый" водород, или дейтерий), 3Н, или Т (радиоактивный "сверхтяжелый" водород, или тритий), 16О, 17О, 18О. Поэтому и сама вода имеет переменный изотопный состав. Природная вода — это смесь вод разного изотопного состава. Наиболее распространена вода, состоящая из изотопов 1Н и 16О, доля других изотопных видов воды ничтожна — менее 0,27 %. Одна из главных причин, приводящих к различию изотопного состава природных вод – процесс испарения. В результате испарения происходит некоторое обогащение воды более тяжелыми изотопами, и в результате конденсации — более легкими. Поэтому поверхностные воды, формирующиеся атмосферными осадками, содержат "тяжелого" водорода (3Н) и "тяжелого" кислорода (18O) меньше, чем океанические воды.
Воду с изотопным составом 1Н216О называют "обычной" водой и обозначают просто Н2О, остальные виды воды (кроме 3Н2О) называют "тяжелой" водой. Иногда "тяжелой" водой считают лишь дейтериевую воду 2Н20 (или D2О). Вода с изотопным составом 4Н2О (или Т2О) – так называемая "сверхтяжелая" вода. Ее на Земле находится всего 13–20 кг. Приведенные в дальнейшем сведения относятся только к "обычной" воде.
