
- •Применение
- •Аномалии воды
- •Кислотно-основные свойства
- •Окислительно-восстановительные свойства
- •Физические свойства
- •Химические свойства
- •Получение
- •Применение
- •ОБЩАЯ ХАРАКТЕРИСТИКА
- •ФТОР И ЕГО СОЕДИНЕНИЯ
- •Физические свойства
- •Химические свойства
- •Фтористый водород
- •Физические свойства
- •Химические свойства
- •ХЛОР И ЕГО СОЕДИНЕНИЯ
- •Физические свойства
- •Химические свойства
- •Соединения хлора Хлористый водород
- •Физические свойства
- •Химические свойства
- •Кислородсодержащие кислоты хлора
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •БРОМ И ЕГО СОЕДИНЕНИЯ
- •Физические свойства
- •Химические свойства
- •Бромистый водород HBr
- •Физические свойства
- •Химические свойства
- •ИОД И ЕГО СОЕДИНЕНИЯ
- •Физические свойства
- •Химические свойства
- •Иодистый водород
- •Физические свойства
- •Химические свойства
- •Кислородные кислоты йода
- •ОБЩАЯ ХАРАКТЕРИСТИКА
- •КИСЛОРОД
- •Физические свойства
- •Способы получения
- •Способы собирания
- •Химические свойства
- •Горение в кислороде
- •Озон O3
- •Физические свойства
- •Химические свойства
- •СЕРА И ЕЕ СОЕДИНЕНИЯ
- •СЕРА
- •Физические свойства
- •Аллотропия
- •Строение атома
- •Получение
- •Химические свойства
- •Реакции диспропорционирования:
- •Применение
- •СЕРОВОДОРОД
- •Физические свойства
- •Получение
- •Химические свойства
- •Сульфиды
- •Получение
- •Химические свойства
- •ОКСИДЫ СЕРЫ
- •Оксид серы IV
- •Физические свойства
- •Получение
- •Химические свойства
- •Оксид серы VI
- •Физические свойства
- •Получение
- •Химические свойства
- •СЕРНАЯ КИСЛОТА
- •Физические свойства
- •Производство серной кислоты
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •ОБЩАЯ ХАРАКТЕРИСТИКА
- •Общая характеристика элементов главной подгруппы V группы (подгруппы азота)
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •АЗОТ И ЕГО СОЕДИНЕНИЯ
- •ПОДГРУППА АЗОТА
- •АЗОТ
- •Физические свойства
- •Получение
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •АММИАК
- •Строение
- •Физические свойства
- •Получение
- •Химические свойства
- •Образование ковалентной связи по донорно-акцепторному механизму.
- •Аммиак - восстановитель (окисляется до N2+1O или N+2O)
- •ПОДГРУППА АЗОТА
- •СОЛИ АММОНИЯ
- •Физические свойства
- •Получение
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •ОКСИДЫ АЗОТА
- •Оксид азота (I)
- •N2+1O закись азота, "веселящий газ"
- •Физические свойства
- •Получение
- •Химические свойства
- •Оксид азота (II)
- •N+2O окись азота
- •Получение
- •Химические свойства
- •Оксид азота (III)
- •Физические свойства
- •Получение
- •Химические свойства
- •Оксид азота (IV)
- •N+4O2 двуокись азота, диоксид азота
- •Физические свойства
- •Получение
- •Химические свойства
- •Оксид азота (V)
- •N2+5O5 азотный ангидрид
- •Физические свойства
- •Получение
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •АЗОТИСТАЯ КИСЛОТА
- •HNO2 Азотистая кислота
- •Физические свойства
- •Получение
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •АЗОТНАЯ КИСЛОТА
- •HNO3 Азотная кислота
- •Физические свойства
- •Получение
- •Химические свойства
- •Специфические свойства азотной кислоты
- •Сильный окислитель
- •ПОДГРУППА АЗОТА
- •РАЗЛОЖЕНИЕ НИТРАТОВ
- •Реакции разложения нитратов при нагревании
- •ПОДГРУППА АЗОТА
- •ФОСФОР И ЕГО СОЕДИНЕНИЯ
- •Важнейшие аллотропные модификации
- •Получение
- •Химические свойства.
- •Соединения фосфора
- •Получение
- •Химические свойства.
- •P2+3 O3 Фосфористый ангидрид (оксид фосфора (III)).
- •Получение
- •Химические свойства
- •P2+5O5 Фосфорный ангидрид (оксид фосфора (V)).
- •Получение
- •Химические свойства
- •HP+5O3 Метафосфорная кислота.
- •Получение
- •Химические свойства
- •H3P+5O3 Фосфористая кислота
- •Получение
- •Химические свойства
- •H3P+5O4 Ортофосфорная кислота.
- •Диссоциация:
- •Получение
- •Химические свойства
- •Фосфорные удобрения
- •Фосфоритная мука
- •УГЛЕРОД
- •Аллотропия
- •Алмаз
- •Карбин
- •Адсорбция
- •Химические свойства
- •Химические свойства
- •Способы собирания
- •Химические свойства
- •Качественная реакция
- •Угольная кислота и её соли
- •КРЕМНИЙ
- •Аллотропия
- •Химические свойства
- •Химические свойства
- •Физические свойства
- •Кислотный оксид
- •Кремниевые кислоты
- •ОБЩИЕ СВОЙСТВА
- •Положение металлов в периодической таблице
- •Общие свойства металлов Виды кристаллических решеток
- •Общие физические свойства
- •Общие химические свойства металлов
- •ЩЕЛОЧНЫЕ МЕТАЛЛЫ
- •Общая характеристика
- •Свойства щелочных металлов
- •Физические свойства
- •Химические свойства
- •Нахождение в природе
- •Химические свойства
- •Оксиды щелочных металлов – R2O
- •Получение
- •Химические свойства
- •Пероксид натрия Na2O2
- •Получение
- •Химические свойства
- •Надпероксид калия KO2
- •Получение
- •Химические свойства
- •Гидроксиды щелочных металлов – ROH
- •Получение
- •Химические свойства
- •МЕТАЛЛЫ
- •ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
- •Свойства щелочноземельных металлов
- •Физические свойства
- •Химические свойства
- •Нахождение в природе
- •Получение
- •Оксиды щелочноземельных металлов
- •Получение
- •Химические свойства
- •Гидроксиды щелочноземельных металлов R(OH)2
- •Получение
- •Химические свойства
- •Жесткость воды
- •ПОДГРУППА АЛЮМИНИЯ
- •Свойства элементов подгруппы алюминия
- •Физические свойства
- •Химические свойства
- •Алюминий
- •Физические свойства
- •Нахождение в природе
- •Получение
- •Химические свойства
- •Применение
- •Получение
- •Гидроксид алюминия
- •Получение
- •ПЕРЕХОДНЫЕ МЕТАЛЛЫ
- •Общие свойства
- •ПОДГРУППА ЖЕЛЕЗА
- •Свойства элементов подгруппы железа
- •Получение металлов подгруппы железа
- •Железо и его соединения
- •Химические свойства
- •Соединения двухвалентного железа
- •Гидроксид железа (II)
- •Качественная реакция на Fe2+
- •Соединения трёхвалентного железа
- •Оксид железа (III)
- •Гидроксид железа (III)
- •Качественные реакции на Fe3+
- •Кобальт и его соединения
- •Гидроксид кобальта (II)
- •Никель и его соединения
- •ПОДГРУППА МЕДИ
- •Подгруппа меди – побочная подгруппа I группы
- •Свойства элементов подгруппы меди
- •Физические свойства
- •Химические свойства
- •Медь и её соединения
- •Получение
- •Химические свойства
- •Соединения одновалентной меди
- •Соединения двухвалентной меди
- •Серебро и его соединения
- •Золото и его соединения
- •ПОДГРУППА МАРГАНЦА
- •Подгруппа марганца
- •Побочная подгруппа VII группы
- •Свойства элементов подгруппы марганца
- •Физические свойства
- •Химические свойства
- •Марганец и его соединения
- •Марганец
- •Получение
- •Химические свойства
- •Соединения Mn(II)
- •ПОДГРУППА ХРОМА
- •Подгруппа хрома - побочная подгруппа VI группы
- •Свойства элементов подгруппы хрома
- •Физические свойства
- •Химические свойства
- •Хром и его соединения
- •Получение
- •Соединения хрома
- •Соединения двухвалентного хрома
- •Соединения трёхвалентного хрома
- •Соединения шестивалентного хрома
- •ПОДГРУППА ЦИНКА
- •Физические свойства
- •Химические свойства
- •Цинк и его соединения
- •Кадмий и его соединения
- •Ртуть и ее соединения
- •Получение
- •Химические свойства.
- •Галогениды ртути (II)
- •Получение
- •Химические свойства:
При прокаливании Co(OH)2 образует оксид кобальта (II) CoO:
Co(OH)2 –t°→ CoO + H2O
Cоединения кобальта склонны к комплексообразованию (координационное число=6):
Co(OH)2 + 6NH3 → [Co(NH3)](OH)2
Никель и его соединения
Никель легко растворяется в разбавленной азотной кислоте и медленно в соляной и серной кислотах
Ni + 2HCl → NiCl2 + H2↑
Ион Ni2+ в водных растворах имеет зелёную окраску. Для никеля наиболее характерна степень
окисления +2. Оксид и гидроксид никеля проявляют основной характер.
NiO + H2SO4 –t°→ NiSO4 + H2O
NiCl2 + 2NaOH –t°→ Ni(OH)2↓(зелёный) + 2NaCl
Ni(OH)2 + H2SO4 → NiSO4 + 2H2O
Соединения двухвалентного никеля могут давать комплексы с аммиаком:
Ni(OH)2 + 6NH2 → [Ni(NH3)6](OH)2
МЕТАЛЛЫ
ПОДГРУППА МЕДИ
Подгруппа меди – побочная подгруппа I группы
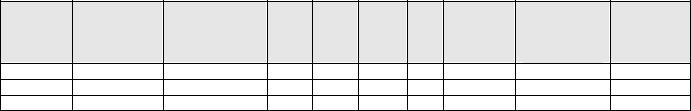
Свойства элементов подгруппы меди
Атомный |
Название |
Электронная |
ρ |
t°пл. |
t°кип. ЭО |
Атомный |
Удельная |
Степень |
|
номер |
|
конфигурация |
г/см3 |
°C |
°C |
|
радиус, |
злектро- |
окисления |
|
|
|
|
|
|
|
нм |
проводность |
|
|
|
[Ar] 3d104s1 |
|
|
|
|
|
м,мм-2,ом-1 |
|
29 |
Медь Cu |
8,96 |
1083 |
2595 |
1,9 |
0,127 |
58,1 |
+1,+2 |
|
47 |
Серебро Ag |
[Kr] 4d105s1 |
10,5 |
960 |
2180 |
1,9 |
0,144 |
61,0 |
+1 |
79 |
Золото Au |
[Xe]4f145d106s1 |
19,3 |
1064 |
2700 |
2,4 |
0,144 |
41,3 |
+1,+3 |
Физические свойства
1.Высокие значения плотности, температур плавления и кипения.
2.Высокая тепло- и электропроводность.
Химические свойства
Химическая активность небольшая, убывает с увеличением атомного номера.
