
- •Применение
- •Аномалии воды
- •Кислотно-основные свойства
- •Окислительно-восстановительные свойства
- •Физические свойства
- •Химические свойства
- •Получение
- •Применение
- •ОБЩАЯ ХАРАКТЕРИСТИКА
- •ФТОР И ЕГО СОЕДИНЕНИЯ
- •Физические свойства
- •Химические свойства
- •Фтористый водород
- •Физические свойства
- •Химические свойства
- •ХЛОР И ЕГО СОЕДИНЕНИЯ
- •Физические свойства
- •Химические свойства
- •Соединения хлора Хлористый водород
- •Физические свойства
- •Химические свойства
- •Кислородсодержащие кислоты хлора
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •БРОМ И ЕГО СОЕДИНЕНИЯ
- •Физические свойства
- •Химические свойства
- •Бромистый водород HBr
- •Физические свойства
- •Химические свойства
- •ИОД И ЕГО СОЕДИНЕНИЯ
- •Физические свойства
- •Химические свойства
- •Иодистый водород
- •Физические свойства
- •Химические свойства
- •Кислородные кислоты йода
- •ОБЩАЯ ХАРАКТЕРИСТИКА
- •КИСЛОРОД
- •Физические свойства
- •Способы получения
- •Способы собирания
- •Химические свойства
- •Горение в кислороде
- •Озон O3
- •Физические свойства
- •Химические свойства
- •СЕРА И ЕЕ СОЕДИНЕНИЯ
- •СЕРА
- •Физические свойства
- •Аллотропия
- •Строение атома
- •Получение
- •Химические свойства
- •Реакции диспропорционирования:
- •Применение
- •СЕРОВОДОРОД
- •Физические свойства
- •Получение
- •Химические свойства
- •Сульфиды
- •Получение
- •Химические свойства
- •ОКСИДЫ СЕРЫ
- •Оксид серы IV
- •Физические свойства
- •Получение
- •Химические свойства
- •Оксид серы VI
- •Физические свойства
- •Получение
- •Химические свойства
- •СЕРНАЯ КИСЛОТА
- •Физические свойства
- •Производство серной кислоты
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •ОБЩАЯ ХАРАКТЕРИСТИКА
- •Общая характеристика элементов главной подгруппы V группы (подгруппы азота)
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •АЗОТ И ЕГО СОЕДИНЕНИЯ
- •ПОДГРУППА АЗОТА
- •АЗОТ
- •Физические свойства
- •Получение
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •АММИАК
- •Строение
- •Физические свойства
- •Получение
- •Химические свойства
- •Образование ковалентной связи по донорно-акцепторному механизму.
- •Аммиак - восстановитель (окисляется до N2+1O или N+2O)
- •ПОДГРУППА АЗОТА
- •СОЛИ АММОНИЯ
- •Физические свойства
- •Получение
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •ОКСИДЫ АЗОТА
- •Оксид азота (I)
- •N2+1O закись азота, "веселящий газ"
- •Физические свойства
- •Получение
- •Химические свойства
- •Оксид азота (II)
- •N+2O окись азота
- •Получение
- •Химические свойства
- •Оксид азота (III)
- •Физические свойства
- •Получение
- •Химические свойства
- •Оксид азота (IV)
- •N+4O2 двуокись азота, диоксид азота
- •Физические свойства
- •Получение
- •Химические свойства
- •Оксид азота (V)
- •N2+5O5 азотный ангидрид
- •Физические свойства
- •Получение
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •АЗОТИСТАЯ КИСЛОТА
- •HNO2 Азотистая кислота
- •Физические свойства
- •Получение
- •Химические свойства
- •ПОДГРУППА АЗОТА
- •АЗОТНАЯ КИСЛОТА
- •HNO3 Азотная кислота
- •Физические свойства
- •Получение
- •Химические свойства
- •Специфические свойства азотной кислоты
- •Сильный окислитель
- •ПОДГРУППА АЗОТА
- •РАЗЛОЖЕНИЕ НИТРАТОВ
- •Реакции разложения нитратов при нагревании
- •ПОДГРУППА АЗОТА
- •ФОСФОР И ЕГО СОЕДИНЕНИЯ
- •Важнейшие аллотропные модификации
- •Получение
- •Химические свойства.
- •Соединения фосфора
- •Получение
- •Химические свойства.
- •P2+3 O3 Фосфористый ангидрид (оксид фосфора (III)).
- •Получение
- •Химические свойства
- •P2+5O5 Фосфорный ангидрид (оксид фосфора (V)).
- •Получение
- •Химические свойства
- •HP+5O3 Метафосфорная кислота.
- •Получение
- •Химические свойства
- •H3P+5O3 Фосфористая кислота
- •Получение
- •Химические свойства
- •H3P+5O4 Ортофосфорная кислота.
- •Диссоциация:
- •Получение
- •Химические свойства
- •Фосфорные удобрения
- •Фосфоритная мука
- •УГЛЕРОД
- •Аллотропия
- •Алмаз
- •Карбин
- •Адсорбция
- •Химические свойства
- •Химические свойства
- •Способы собирания
- •Химические свойства
- •Качественная реакция
- •Угольная кислота и её соли
- •КРЕМНИЙ
- •Аллотропия
- •Химические свойства
- •Химические свойства
- •Физические свойства
- •Кислотный оксид
- •Кремниевые кислоты
- •ОБЩИЕ СВОЙСТВА
- •Положение металлов в периодической таблице
- •Общие свойства металлов Виды кристаллических решеток
- •Общие физические свойства
- •Общие химические свойства металлов
- •ЩЕЛОЧНЫЕ МЕТАЛЛЫ
- •Общая характеристика
- •Свойства щелочных металлов
- •Физические свойства
- •Химические свойства
- •Нахождение в природе
- •Химические свойства
- •Оксиды щелочных металлов – R2O
- •Получение
- •Химические свойства
- •Пероксид натрия Na2O2
- •Получение
- •Химические свойства
- •Надпероксид калия KO2
- •Получение
- •Химические свойства
- •Гидроксиды щелочных металлов – ROH
- •Получение
- •Химические свойства
- •МЕТАЛЛЫ
- •ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
- •Свойства щелочноземельных металлов
- •Физические свойства
- •Химические свойства
- •Нахождение в природе
- •Получение
- •Оксиды щелочноземельных металлов
- •Получение
- •Химические свойства
- •Гидроксиды щелочноземельных металлов R(OH)2
- •Получение
- •Химические свойства
- •Жесткость воды
- •ПОДГРУППА АЛЮМИНИЯ
- •Свойства элементов подгруппы алюминия
- •Физические свойства
- •Химические свойства
- •Алюминий
- •Физические свойства
- •Нахождение в природе
- •Получение
- •Химические свойства
- •Применение
- •Получение
- •Гидроксид алюминия
- •Получение
- •ПЕРЕХОДНЫЕ МЕТАЛЛЫ
- •Общие свойства
- •ПОДГРУППА ЖЕЛЕЗА
- •Свойства элементов подгруппы железа
- •Получение металлов подгруппы железа
- •Железо и его соединения
- •Химические свойства
- •Соединения двухвалентного железа
- •Гидроксид железа (II)
- •Качественная реакция на Fe2+
- •Соединения трёхвалентного железа
- •Оксид железа (III)
- •Гидроксид железа (III)
- •Качественные реакции на Fe3+
- •Кобальт и его соединения
- •Гидроксид кобальта (II)
- •Никель и его соединения
- •ПОДГРУППА МЕДИ
- •Подгруппа меди – побочная подгруппа I группы
- •Свойства элементов подгруппы меди
- •Физические свойства
- •Химические свойства
- •Медь и её соединения
- •Получение
- •Химические свойства
- •Соединения одновалентной меди
- •Соединения двухвалентной меди
- •Серебро и его соединения
- •Золото и его соединения
- •ПОДГРУППА МАРГАНЦА
- •Подгруппа марганца
- •Побочная подгруппа VII группы
- •Свойства элементов подгруппы марганца
- •Физические свойства
- •Химические свойства
- •Марганец и его соединения
- •Марганец
- •Получение
- •Химические свойства
- •Соединения Mn(II)
- •ПОДГРУППА ХРОМА
- •Подгруппа хрома - побочная подгруппа VI группы
- •Свойства элементов подгруппы хрома
- •Физические свойства
- •Химические свойства
- •Хром и его соединения
- •Получение
- •Соединения хрома
- •Соединения двухвалентного хрома
- •Соединения трёхвалентного хрома
- •Соединения шестивалентного хрома
- •ПОДГРУППА ЦИНКА
- •Физические свойства
- •Химические свойства
- •Цинк и его соединения
- •Кадмий и его соединения
- •Ртуть и ее соединения
- •Получение
- •Химические свойства.
- •Галогениды ртути (II)
- •Получение
- •Химические свойства:
Неорганическая
химия

ВОДОРОД
Водород H - первый элемент в периодической системе, самый распространённый элемент во
Вселенной (92%); в земной коре массовая доля водорода составляет всего 1%.
Впервые выделен в чистом виде Г. Кавендишем в 1766 г. В 1787г. А.Лавуазье доказал, что водород - химический элемент.
Атом водорода состоит из ядра и одного электрона. Электронная конфигурация - 1S1. Молекула водорода двухатомная. Связь ковалентная неполярная.
Радиус атома - (0,08 нм); потенциал ионизации (ПИ) - (13,6 эВ);
электроотрицательность (ЭО) - (2,1); степени окисления - (-1; +1).
Изотопы:
11Н - протий (99,98% по массе);
21D - дейтерий (0,02%);
31T - тритий (получен искусственно).
Физические свойства.
Водород - газ, бесцветный, без запаха; t°кип = -253°C; t°пл = -259°C; почти не растворяется в воде (в 100V H2O растворяется 2V H2); легче воздуха. D (по воздуху) = 0,069.
Способы собирания.
Вытеснением воды |
Вытеснением воздуха |
Получение
1) взаимодействие активных металлов с кислотами - неокислителями:
Zn + 2HCl → ZnCl2 + H2↑
2) взаимодействие алюминия (или цинка) с водными растворами щелочей:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
3) электролиз воды и водных растворов щелочей и солей:
2H2O → 2H2↑ + O2↑
2NaCl + 2H2O → H2↑ + Cl2↑ + 2NaOH
4) пропускание паров воды над раскалённым углём при 1000°C:
C + H2O ↔ CO + H2
5) конверсия метана при 900°C:
CH4 + H2O ↔ CO + 3H2
Методы (1,2) используют в лаборатории, (3-5) используют в промышленности.
Химические свойства
При обычных условиях малоактивен (реагирует только с фтором)
Восстановительные свойства:
1) с неметаллами:
2H20 + O2 → 2H2+1O (со взрывом при поджоге)
H20 + S –150-250°→ H2+1S
3H20 + N2 ←p;t°→ 2NH3+1
(в присутствии железного катализатора)
H20 + F2 → 2HF (со взрывом)
H2 + I2 ←t°→ 2H+1I-1
2) с оксидами металлов:
H20 + СuO –t°→ Cu + H2O
(метод получения малоактивных металлов Pb, Mo, W, Ni, Cu и др. из их оксидов)
Окислительные свойства
3) с щелочными и щелочноземельными металлами:
H20 + 2Li0 → 2Li+1H-1
H20 + Ca0 → Ca+2H2-1
Гидриды MeHn - сильные восстановители за счёт водорода в степени окисления (-1).
Разлагаются водой и кислотами:
NaH + H2O → NaOH + H2↑
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
LiH + HCl → LiCl + H2↑
Применение
1)Для промышленного синтеза NH3, HCl, CH3OH (реакцией CO + 2H2 –p;t°;kat→ CH3OH)
2)Восстановление редких металлов из оксидов (W, Mo и др.).
3)Гидрирование органических соединений (в частности, гидрогенизация растительных масел
в твёрдые жиры).
4)Для сварки и резки металлов водородно-кислородным пламенем.
ВОДА
Вода H2O - самое распространённое в природе химическое соединение.
Запасы воды на Земле:
вморях и океанах - 1,4 млрд. км3
вледниках - 30 млн. км3
вреках и озёрах - 2 млн. км3
ватмосфере - 14 тыс. км3
вживых организмах - 65%
Молекула полярна; угол 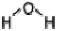 -104,5°; связь O–H ковалентная полярная.
-104,5°; связь O–H ковалентная полярная.
Вода является дипольным растворителем (растворяет многие газы, жидкие и твёрдые вещества).
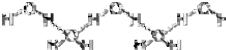
Между молекулами воды - водородные связи:
Аномалии воды
1)Лёд плавает на поверхности водоёма, ρ(льда) = 0,92 г/см3, max ρ(воды) при +4°С = 1г/см3
2)При замерзании воды происходит расширение объёма.
3)Самая большая теплоёмкость (в 3100 раз больше, чем у воздуха; в 4 раза больше, чем у горных пород).
Кислотно-основные свойства
1) Слабый электролит:
H2O ↔ H+ + OH-
2)Вода – амфотерное вещество. Она реагирует как с основными оксидами (оксидами
щелочных и щелочноземельных металлов), так и с кислотными оксидами (кроме SiO2).
Li2O + H2O → 2LiOH
MgO + H2O → Mg(OH)2
SO3 + H2O → H2SO4
3) Гидролиз некоторых солей приводит к их полному разложению:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Al2(CO3)3 + 6H2O → 2Al(OH)3↓ + 3H2O + 3CO2↑
4)Вода разлагает гидриды, фосфиды, карбиды, нитриды и некоторые другие бинарные
соединения активных металлов с неметаллами:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3↑
CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3↑
5) Молекулы воды с некоторыми солями дают кристаллогидраты:
