
- •Ферменты
- •История
- •Свойства
- •Классификация
- •Особенности ферментативного катализа
- •Ферментативная реакция
- •Строение ферментов
- •Активный центр
- •Номенклатура
- •Классификация
- •З ависимость скорости ферментативной реакции
- •Специфичность ферментов, ее виды
- •Эффекторы
- •1 )Конкурентное ингибирование
- •2)Неконкурентное ингибирование
- •3)Бесконкурентное ингибирование
- •Аллостерический центр
- •Регуляция ферментативной активности.
- •Энзимология
З ависимость скорости ферментативной реакции
от Температуры
Повышение температуры свыше 45-50˚С →тепловая денатурация→инактивпция (исключение – миокиназа мышц, папаин).
С повышением температуры ускоряется движение молекул→повышение вероятности взаимодействия реагирующих в-в.
-температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции
-скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением активности, возникающим из-за термической денатурации белковой мол-лы.
П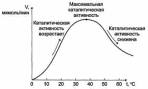 онижение
температуры
не разрушает, а приостанавливает
действие фермента
онижение
температуры
не разрушает, а приостанавливает
действие фермента
Холодовая инактивация ферментов обратима, термическая – нет, т.к. она связана с разрушением нативной структуры белка-фермента
Согласно правилу Вант-Гоффа при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается приблизительно в 2-4 раза. Это правило выполняется и для ферментов, но только в пределах до 40-42ºС, затем скорость реакции начинает снижаться, что связано с денату-рацией белка.
Температурный оптимум (скорость реакции максимальна)= 37-38-40˚С(искл: термостабильные ферменты: Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. -используют в научно-практической
медицине для молекулярной диагностики заболеваний с использованием (ПЦР)
о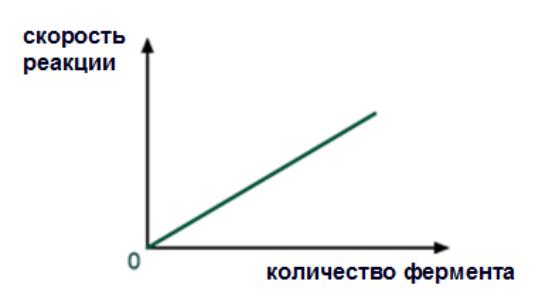 т
Концентрации фермента и субстрата
т
Концентрации фермента и субстрата
С Фермента
При увеличении - скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта.
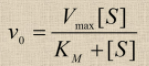
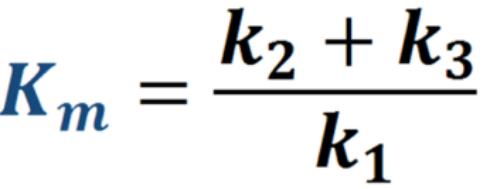
В целом скорость реакции зависит от скорости образования фермент-субстратного комплекса и скорости его разрушения или превращения в фермент-продуктный.
Каждая из этих реакций характеризуется своей константой скорости (k). Для упрощения уравнения была введена объединѐнная константа Михаэлиса, которая учитывает все три константы:
Зависимость скорости от концентрации субстрата описывается уравнением Михаэлиса-Метнен:
С Субстрата
При увеличении скорость реакции сначала возрастает (т.к. к катализу добавляемых молекул субстрата подключаются новые и новые молекулы фермента)→ скорость накопления продукта возрастает→ увеличение активности фермента. Затем→ скорость перестаѐт увеличиваться (плато на кривой), (все молекулы фермента заняты молекулами субстрата и непрерывно ведут катализ)-здесь скорость реакции максимальна, т.е. наступает насыщение фермента
1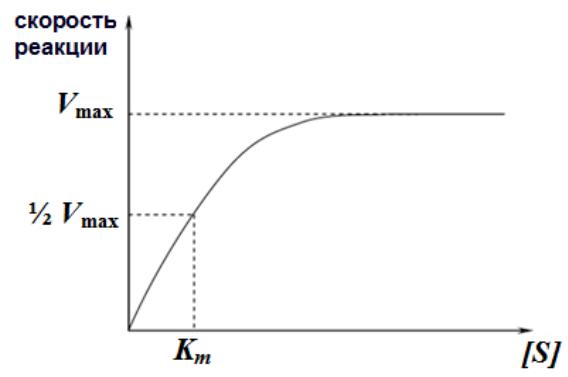 .
на начальных этапах концентрация
субстрата значительно меньше Km ([S]
<< Km). В этом случае знаменатель
уравнения мало изменяется при из-менении
[S], а величина скорости реакции V прямо
пропорциональна [S] (график линеен).
.
на начальных этапах концентрация
субстрата значительно меньше Km ([S]
<< Km). В этом случае знаменатель
уравнения мало изменяется при из-менении
[S], а величина скорости реакции V прямо
пропорциональна [S] (график линеен).
2. когда концентрация субстрата значительно больше Km ([S] >> Km), величиной Km можно пренебречь и при решении получим, что скорость реакции максимальна (плато на графике).
3. если концентрация субстрата равна величине константы Михаэлиса ([S] = Km), по уравнению Михаэлиса-Ментен получаем, что скорость реакции V будет равна половине максимальной Vmax (V = ½ Vmax). Таким образом, Km соответствует концентрации субстрата, при которой скорость реакции равна половине максимальной.
от Реакции среды
О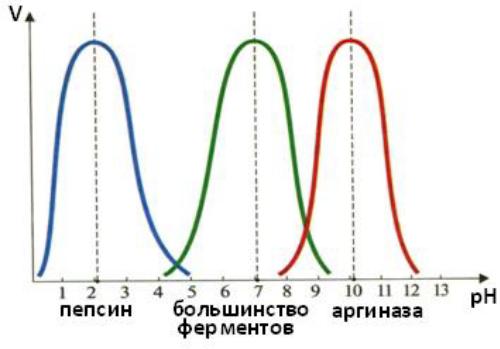 птимум
рН среды
-значение рН среды, при котором фермент
проявляет максимальную активность для
действия данного фермента.
птимум
рН среды
-значение рН среды, при котором фермент
проявляет максимальную активность для
действия данного фермента.
-лежит в пределах физиологических значений 6,0-8,0. (исключения: пепсин, (2,0); аргиназа – (10,0)
Зависимость скорости реакции от концентрации водородных ионов
определяется двумя факторами:
1.ионы Н+ и ОН− влияют на степень диссоциации ионогенных групп, т.е.
на конформацию белка;
2.ионы Н+ и ОН− влияют на сродство фермента и субстрата, т.к. могут вызывать и изменения конформации субстрата.
При небольшом сдвиге кислотности среды от оптимума скорость реак-ции уменьшается обратимо, при значительном – может насупить кислотная (или щелочная) денатурация, и фермент инактивируется необратимо.
