
- •Ферменты
- •История
- •Свойства
- •Классификация
- •Особенности ферментативного катализа
- •Ферментативная реакция
- •Строение ферментов
- •Активный центр
- •Номенклатура
- •Классификация
- •З ависимость скорости ферментативной реакции
- •Специфичность ферментов, ее виды
- •Эффекторы
- •1 )Конкурентное ингибирование
- •2)Неконкурентное ингибирование
- •3)Бесконкурентное ингибирование
- •Аллостерический центр
- •Регуляция ферментативной активности.
- •Энзимология
Особенности ферментативного катализа
В основе каталитического действия - способность высокоизбирательно образовывать белково-лигандные комплексы с субстратами (веществами, на которые направлено их действие) и вызывать химические превращения субстратов.
Катализ (греч.κατάλσσις – «разрушение») – изменение скорости химической реакции в присутствии катализаторов
Теории катализа:
1)Гетерогенный катализ: реагирующие вещества и катализатор находятся в разных агрегатных состояниях, и химическая реакция ускоряется за счѐт повышения концентрации реагирующих соединений на поверхности раздела фаз
2)Гомогенный катализ: действие катализатора связано с тем, что он всту-пает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии акти-вации.
Теория ферментативного катализа включает в себя элементы гомогенного и гетерогенного катализов
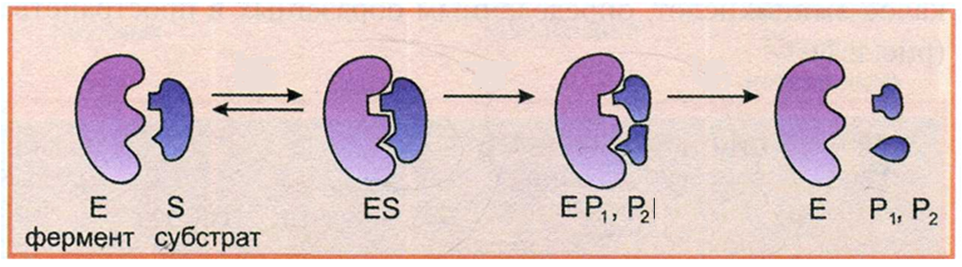
1)Фермент адсорбирует в активном центре субстрат и образует с ним нестойкое промежуточное соединение (фермент-субстратный комплекс)
2)В активном центре происходят химические превращения субстрата, и фермент-субстратный комплекс преобразуется в фермент-продуктный комплекс;
3)фермент-продуктный комплекс диссоциирует на свободный фермент и продукт реакции
![]()


-
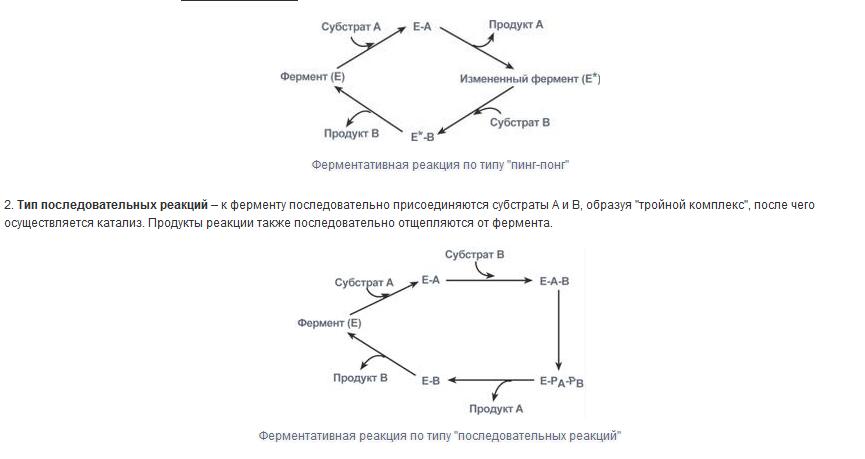
Ферментативная реакция
В организме каждая химическая реакция протекает на определенном энергетическом уровне, при определённой энергии активации.
- снижение
энергию активации путем увеличения
числа активированных молекул, которые
становятся реакционными на более низком
энергетическом уровне.
снижение
энергию активации путем увеличения
числа активированных молекул, которые
становятся реакционными на более низком
энергетическом уровне.
-субстрат (S) -вещество, химические превращения которого в продукт (Р) катализирует фермент (Е).
Стадии
I происходит сближение и ориентация, а также устанавливается индуцированное комплементарное соответствие между ферментом и субстратом, в результате образуется фермент-субстратный комплекс (ЕS).
II возникает напряжение и деформация субстрата, в результате чего происходит сдвиг электронной плотности, изменение степени поляризации, связи в молекуле субстрата деформируются и легко распадаются.
В процессе образования фермент-субстратного комплекса достигается переходное состояние, характеризующееся низкой энергией активации, в результате чего образуется новый продукт, а после его диссоциации фермент возвращается в исходное состояние.
Строение ферментов
П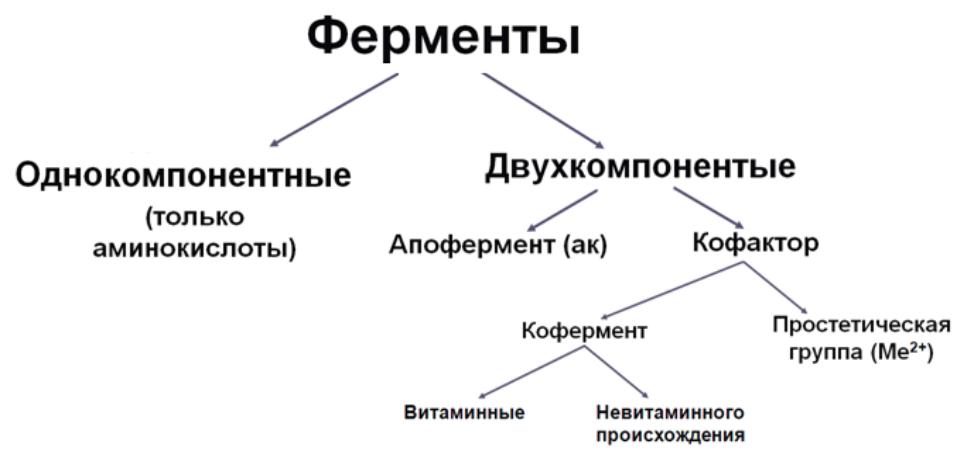 о
составу ферменты делятся на простые и
сложные
о
составу ферменты делятся на простые и
сложные
Простые -состоят из аминокислот (ферменты желудочно-кишечного тракта – α-амилаза, пепсин, трипсин, липаза и др. 3 класс – гидролаз)
Сложные -состоят из белковой части – апофермента и небелковой – кофактора (ионы металлов, так и органические соединения, многие из которых являются производными витаминов). Каталитически активный комплекс «фермент – кофактор» называется холоферментом.
Кофактор- небелковая часть ферментов:
-Простетическая группа-коферменты, которые прочно (часто ковалентно) связаны с апоферментом. Например, флавиновые дегидрогеназы состоят из белка и простетических групп ФАД, ФМН, производных витамина В2. Апофермент определяет направленность или специфичность действия фермента, прочно связана с белковой частью (ионы металлов, гем), еѐ невозможно отделить от апофермента, не разрушив при этом фермент;
-Кофермент- органические вещества, которые непрочно связаны с белковой частью (пр:НАД-зависимые дегидрогеназы состоят из белка и коферментов НАД, НАДФ, производных витамина РР, соединение белковой и небелковой частей происходит только на время биокатализа, и затем образованный ко мплекс легко разрушается
