
- •Ферменты
- •История
- •Свойства
- •Классификация
- •Особенности ферментативного катализа
- •Ферментативная реакция
- •Строение ферментов
- •Активный центр
- •Номенклатура
- •Классификация
- •З ависимость скорости ферментативной реакции
- •Специфичность ферментов, ее виды
- •Эффекторы
- •1 )Конкурентное ингибирование
- •2)Неконкурентное ингибирование
- •3)Бесконкурентное ингибирование
- •Аллостерический центр
- •Регуляция ферментативной активности.
- •Энзимология
Номенклатура
1.Тривиальные названия ферментов (пепсин, трипсин, химотрипсин).
2. Рабочее: по типу катализируемой реакции (дегидрирование – дегидрогеназа, карбоксилирование – карбоксилаза).
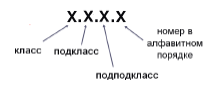
3. Систематическое название (международная классификациия): 1972 г
Название субстрата + суффикс –аза
( Пр:,
лактат: НАД+- оксидоредуктаза, ацетил-КоА:
холин-О-ацетил-трансфераза; липиды –
липаза, сахароза – сахараза)
Пр:,
лактат: НАД+- оксидоредуктаза, ацетил-КоА:
холин-О-ацетил-трансфераза; липиды –
липаза, сахароза – сахараза)
Класс 1 – оксидоредуктазы,
Подкласс 1 – окисляет гидроксильную группу,
Подподкласс 1 – акцептором водорода является НАД: алкогольдегидрогеназа
КФ 1.1.1.1. – это оксидоредуктаза, действует на ОН-группу донора с НАД в качестве акцептора с первым порядко-вым номером в своем подподклассе;
И зоэнзимы
отличаются сродством к субстрату,
максимальной скоростью катализируемой
реакции, чувствительностью к ингибиторам
и активаторам, условиями работы (оптимум
pH и температуры). Чаще всего -олигомерные
белки и «собраны» из разных типов
протомеров.
зоэнзимы
отличаются сродством к субстрату,
максимальной скоростью катализируемой
реакции, чувствительностью к ингибиторам
и активаторам, условиями работы (оптимум
pH и температуры). Чаще всего -олигомерные
белки и «собраны» из разных типов
протомеров.
Например, димерный фермент креатинкиназа (КК) 3 изоферментными формы, составленные из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг).(КК1) локализуется в головном мозге, (КК2) – по одной М- и В в миокарде,(КК3) специфична для скелетной мышцы.
Классификация
классы(6): – по типу катализируемой реакции
подклассы – по природе атакуемой химической группы
подподклассы – по характеру атакуемой связи или по природе акцептора
1![]() .
ОКСИДОРЕДУКТАЗЫ–
окислительно-восстановительные
реакции(в основе
.
ОКСИДОРЕДУКТАЗЫ–
окислительно-восстановительные
реакции(в основе
биологического окисления). Систематическое название -«донор-акцептор-
оксидоредуктаза» (например, лактат:НАД+ оксидоредуктаза). -
- 22: дегидрогеназы, оксидазы, моно- и диоксигеназы, пероксидазы.
2![]() .
ТРАНСФЕРАЗЫ
(от
переносимой группы)–катализирующие
межмолекулярный
.
ТРАНСФЕРАЗЫ
(от
переносимой группы)–катализирующие
межмолекулярный
перенос атомов или функциональных групп (т.е. от донора к акцептору):
-9: аминотрансферазы, ацилтрансферазы, метилтрансферазы
3![]() .
ГИДРОЛАЗЫ(по
типу гидролизуемой связи)
–гидролиз
(расщепление
.
ГИДРОЛАЗЫ(по
типу гидролизуемой связи)
–гидролиз
(расщепление
химической связи с присоединением воды в ионной форме по месту разрыва):
-13:– пептидазы, фосфатазы, эстеразы (гидролизуют сложноэфирные связи),
гликозидазы
4![]() .
ЛИАЗЫ
–негидролитический
разрыв химических связей (С О, С С, C N и
других связей),
.
ЛИАЗЫ
–негидролитический
разрыв химических связей (С О, С С, C N и
других связей),
обратимые реакции отщепления различных групп от субстратов негидролитическим путем.
Эти реакции могут сопровождаться образованием двойной связи или присоединением групп
к месту двойной связи.
![]() -7подклассов
-7подклассов
5. ИЗОМЕРАЗЫ - реакции изомеризации, взаимопревращения оптических и
геометрических изомеров, а также внутримолекулярный перенос групп (в этом
случае они называются также «мутазы»).
-5 подклассов
6![]() .
ЛИГАЗЫ
(синтетазы) –присоединение
друг к другу 2 молекул с
.
ЛИГАЗЫ
(синтетазы) –присоединение
друг к другу 2 молекул с
использованием АТФ (или нуклеозидтрифосфатов):
ИЗОФЕРМЕНТЫ -ферменты, катализирующие одну и ту же реакцию, но отличающиеся -по первичной структуре
-локализованы в разных тканях
Л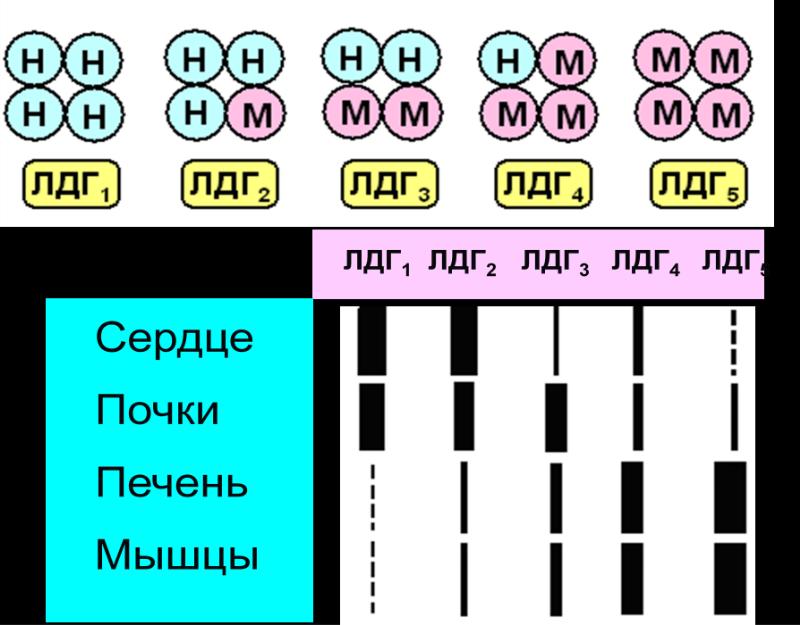 актатдегидрогеназа
(ЛДГ)
является тетрамером и состоит из
субъединиц типа M (англ. muscle – мышца) и
Н (англ. heart – сердце).
актатдегидрогеназа
(ЛДГ)
является тетрамером и состоит из
субъединиц типа M (англ. muscle – мышца) и
Н (англ. heart – сердце).
Существует пять типов ЛДГ с различным составом и локализацией.
ЛДГ 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват.
ЛДГ4 (H1M3) и ЛДГ5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким срод-ством к лактату и катализируют превращение пирувата в лактат.
ЛДГ3 (H2M2)-в тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочеч-ники, лимфатические узлы). Активность разных изоферментов ЛДГ в сыворотке крови имеет клинико-диагностическое значение
ЛДГ катализирует реакцию:
 Глюкоза
ЛДГ 4,5
Глюкоза
ЛДГ 4,5


 ПВК
молочная кислота + 2 АТФ
ПВК
молочная кислота + 2 АТФ
СО2 + Н2О + 38 АТФ ЛДГ 1,2
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ -ферменты,физически (адсорбционное) или химически (ковалентное) связанные с матрицей носителя, которая защищает фермент от инактивирующих воздействий, но в минимальной степени влияет на функционирование его активных центров
Осложнения при работе с ферментами:
–сложность и дороговизна получения достаточных количеств ферментов в чистом виде
--быстро теряют активность под действием различных факторов (изменение Рн, температуры, солевого состава)
--иммунологические
--невозможно создать высокую местную концентрацию фермента при локальных поражениях (не обладают способностью к
«направленному транспорту»)
Материалы носителя: неорганические пористые стекла, силикагели, а также природные или синтетические полимеры.
Виды иммобилизации:.
- реакции ацилирования, в которые могут вступать амино-окси- и некоторые другие группы белка, при этом чаще всего реакция протекает по аминогруппам лизиновых остатков.
- реакция образования азаметиновой связи (оснований Шиффа) м.у. альдегидными группами носителя и аминогруппами белка.
- терапевтические ферменты – иммобилизация на соединениях, характерных для самого организма или даже обладающих собственной биологической активностью, дополняющих или усиливающих действие связанного с ними фермента. Примером может служить фибринолизин, иммобилизованный на гепарине, урокиназа – на альбумине.
- растворимые препараты иммобилизованных ферментов медицинского назначения могут быть получены путем их межмолекулярного слияния. Например, слияние молекул галактозидазы обеспечивает стабилизацию фермента. Одновременно замедляется переваривание фермента и увеличивается время его нахождения в кровотоке.
Преимущества:
-обладают длительным сроком годности
-снижена аллергичность и иммуногенность за счет блокады антигенных участков белка макромолекулой носителя
-слабо восприимчивы к действию естественных ингибиторов
-проявляют терапевтическую активность в течение длительного времени
-более высокая стабильность ферментных препаратов,
-возможность их удаления из реакционной среды и его повторного использования
-возможность создания непрерывных процессов на ферментных колонках
-получение продукта реакции, не загрязнённого ферментом
-носитель обеспечивает устойчивость и направленную доставку фермента предпочтительно в зону поражения, т.е. в
определенный орган или ткань.
Область применения:
-могут быть компонентами аналитических систем для клинического биохимического анализа
-могут служить для модификации внутренних поверхностей, как различного рода протезов, так и медицинских аппаратов
-могут являться компонентами перевязочных и дренирующих материалов, обеспечивающих ускорение заживления и
очищения ран.
Если фермент служит для лечения местных поражений (опухолей, тромбов) и его присутствие в других органах нежелательно, то создаются биосовместимые и биоразлагаемые производные ферментов в виде микрочастиц, гранул, таблеток.
Некоторые иммобилизованные ферменты используются для наружного применения, при включении в состав различных мазей или кремов.
