
Практична робота № 3 (2 години)
Тема Валентність. Ступінь окислення. Окисно-відновні реакції.
1 Мета Навчитися визначати ступінь окислення, валентність елементів за формулою, методом електронного балансу урівнювати рівняння окисно-відновних реакцій.
2 Теоретичне обґрунтування
Валентність - властивість атомів одного хімічного елементу з’єднуватись з певним числом атомів іншого хімічного елемента. Позначають її римськими цифрами над символом хімічного елемента.
Кількісно валентність визначається числом хімічних зв’язків, якими цей атом сполучений з іншими атомами.
Для визначення валентності зручно користуватись графічними формулами сполук, у яких валентність позначають відповідним числом рисок


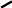 Cl
H - O O О
Cl
H - O O О


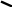
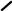
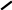 Mg
S
O
Mg
S
O


 Сl
H - O O Р
O
Сl
H - O O Р
O

 Р
O
Р
O
О
Ступінь окислення - це умовний позитивний чи негативний заряд, який міг би виникнути на атомах якби зв’язуючи їх пари електронів повністю змістилися до більш електронегативного елемента.
Наприклад, Валентність та ступінь окислення можуть не співпадати у сполуках
+4 -2 -4 +1 -3 +1 -2 +1 -1 +1
СО2, СН4 , С2Н6 , С2Н4 , С2Н2
С0, а валентність карбону дорівнює 4.
H
N 2
N
N NH3
H - N - H HNO2
H - O - N = O
2
N
N NH3
H - N - H HNO2
H - O - N = O
валентність 3 валентність 3 валентність 3
ст. окислення 0 ст. окислення -3 ст. окислення +3
г
 ідразін
N2H4
Н Н
ідразін
N2H4
Н Н
в алентність 3 N - N
cт. окислення -2 Н Н
Для визначення ступеня окислення атомів у хімічних сполуках слід керуватись такими положеннями:
1 Ступінь окислення атомів в простих речовинах дорівнює нулю - Cu0, P0, H0, Cl20, О20
2 Атоми оксигену в сполуках виявляють ступінь окислення рівний -2 (за винятком пероксидів Н2О2(-1), та фторокисню ОF2(+2).
3 Атоми гідрогену в сполуках виявляють ступінь окислення +1 (за винятком гідридів NaH, СаН2 (-1).
4 В ковалентних сполуках ступінь окислення більш електронегативного атома позначається зі знаком мінус, а менш електронегативного – зі знаком плюс:
N-3H3+1, N+3F3-1, Р-3Н3+1
5 Алгебраїчна сума ступенів окислення всіх атомів. що входять до складу молекул, дорівнює нулю.
+1 +4 -2
Н2СО3
Окисно-відновні процеси
Всі хімічні реакції можна поділити на два типи
1 реакції, які протікають без зміни ступеня окислення атомів, що входять до складу реагуючих речовин (реакції обміну, сполучення, розкладу);
2 реакції, які супроводжуються зміною ступеня окислення атомів реагуючих речовин називаються окисно-відновними.
Окислення – процес віддачі атомом, молекулою чи йоном електронів.
Елемент, що віддає електрони – відновник при цьому ступінь окислення підвищується:
Mg0 - 2е = Mg+2, Н20 - 2е = 2Н+, 2Br- - 2e = Br20
Відновлення - процес приєднання атомом, молекулою чи іоном електронів.
Елемент, що одержує електрони - окисник при цьому ступінь окислення знижується:
Р0 + 3е = Р-3, О20 + 4е = 2О-2, Mg+2 + 2e = Mg0
Процеси окислення і відновлення нерозривно пов’язані між собою. Окислення неможливо без одночасного відновлення. При окисно-відновних реакціях число електронів, які віддає відновник завжди дорівнює числу електронів, одержаних окислювачем – це є окремий випадок закону збереження матерії.
Метод електронного балансу
Метод ґрунтується на розумінні єдності двох протилежних процесів окислення та відновлення
2.1 З’ясувати, які елементи під час реакції змінили ступінь окислення:
Cu0 + HN+5O3 (роз.) Сu+2(+5NO3)2 ++2NO-2 + Н2О
2.2 Скласти рівняння реакції окислення й відновлення для цих атомів і іонів:
Cu0 - 2e Cu+2 відновник, окислюється
N+5 + 3e N+2 окисник, відновлюється
Д ля
числа відданих та приєднаних електронів
(е) слід підібрати найменше спільне
кратне і знайти частки від ділення цього
кратного на число відданих електронів:
ля
числа відданих та приєднаних електронів
(е) слід підібрати найменше спільне
кратне і знайти частки від ділення цього
кратного на число відданих електронів:
C
 u0
- 2e
Cu+2
2
3
u0
- 2e
Cu+2
2
3
6
N+5 + 3e N+2 3 2
3Cu0 + 8HNO3(роз) = 3Cu(NO3)2 + 2NO + 4Н2О
