
- •Альдегиды и кетоны Способы их получения, физические и химические свойства, применение и медико – биологическое значение
- •Альдегиды и кетоны
- •Изомерия и номенклатура альдегидов
- •Номенклатура альдегидов Таблица № 1
- •Электронное и пространственное строение альдегидов на примере этаналя
- •Способы получения альдегидов и кетонов
- •Физические свойства, применение и медико-биологическое значение альдегидов
- •Зависимость температур кипения и плавления альдегидов от длины углеродной цепи
- •Растворимость альдегидов и их применение
- •Запах альдегидов
- •Применение альдегидов
- •Нахождение в природе, запах, применение и токсичность альдегидов Таблица №3
- •Физические свойства, применение и медико-биологическое значение кетонов
- •Зависимость температур кипения и плавления от положения кетогруппы в углеродной цепи
- •Химические свойства альдегидов и кетонов Реакции по карбонильной группе
- •Реакции с аммиаком и аминами
- •Окислительно–восстановительные реакции альдегидов и кетонов.
- •Реакции альдегидов и кетонов с углеводородами.
- •Содержание
Окислительно–восстановительные реакции альдегидов и кетонов.
Реакции горения.
И альдегиды, и кетоны горят с образованием углекислого газа и воды:
![]()
![]()
Аутоокисление альдегидов.
Альдегиды могут самопроизвольно окисляться кислородом воздуха. Такой процесс называется аутоокислением:

Окисление сильными окислителями в жидкой фазе в кислой среде.
Альдегиды можно окислить с помощью хромовой кислоты, например:

пропаналь пропановая кислота


Или перманганатом калия в кислой среде, например:


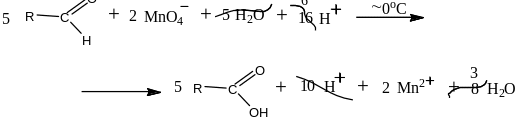
Или с помощью азотной кислоты:
![]()
1,4-бутандиаль 1,4-бутандиовая (янтарная)кислота

![]()
Окисление альдегидов в нейтральной среде.
Альдегиды легко окисляются гипохлоридами натрия и кальция до кислот:
![]()

Гидроксид меди (II) при комнатной температуре медленно окисляет альдегиды до карбоновых кислот, сам восстанвливаясь при этом до жёлтого гидроксида меди (I). Последний при нагревании до ≈ 70ОС разлагается на кирпично-красный оксид меди (I) и воду:

зеленовато-синий жёлтый
![]()
жёлтый кирпично-красный
Окисление альдегидов реактивом Толленса - реакция серебряного зеркала.
Гидроксид диамминсеребра – реактив Толленса легко при комнатной температуре окисляет альдегиды до аммонийных солей карбоновых кислот:




Если стенки стеклянного сосуда, в котором проводилась эта реакция обезжирена, например, действием щелочного раствора перманганата калия, то на стенке образуется зеркальный слой серебра. Поэтому реакция носит название «реакции серебряного зеркала».
Реакция Канниццаро.
Ароматические и гетероциклические альдегиды в щелочной среде диспропорционируют на соответствующие спирты и кислоты:

бензальдегид бензиловый спирт бензойная кислота
 фурфурол
фурфуриловый спирт 2-фуранкарбоновая
(2-формилфуран)
(2-фурилкарбинол)
кислота
фурфурол
фурфуриловый спирт 2-фуранкарбоновая
(2-формилфуран)
(2-фурилкарбинол)
кислота
Алифатические альдегиды так же вступают в эту реакцию, но альдольные конденсации в щелочной среде проходят быстрее и исходный альдегид обычно осмоляется. Однако, если в α-положении нет атомов водорода, то реакция с хорошим выходом проходит и для алифатических альдегидов. Эта реакция называется реакцией Канниццаро-Тищенко:

пивалевый альдегид неопентиловый спирт пивалевая кислота
Формальдегид в щелочной среде так же легко диспропорционирует:

метаналь метанол формиат натрия
Если к смеси ароматического альдегида с избытком формальдегида добавить щелочи, то идет перекрестная реакция Канниццаро, в которой ароматический альдегид восстанавливается, а алифатический окисляется:

Если к безводному альдегиду добавить каталитическое количество алкоголята алюминия, то получается сложный эфир:

Эта реакция носит название реакции Кляйзена – Тищенко.
Реакция Меервейна – Понндорфа – Верлея.
Альдегиды и кетоны можно восстановить с помощью первичного или вторичного спирта в присутствии соответствующих алкоголятов алюминия. Реакция обратима, и равновесие в ней сдвигается в сторону восстановления исходного альдегида большим избытком спирта:

избыток

Восстановление альдегидов и кетонов водорода на гетерогенных катализаторах.
Альдегиды и кетоны можно восстанавливать до первичных и вторичных спиртов соответственно на палладии, платине, хуже на никеле:

2-метилпропаналь 2-метилпропанол (первичный)

3-метилбутанон-2 3-метилбутанол-2 (вторичный)
Восстановление альдегидов и кетонов амальгамированным цинком в соляной кислоте.
По Клемменсену альдегиды и кетоны можно восстановить до алканов:

пропаналь пропан


