
- •Методические указания к лабораторной работе № 1 «Химические свойства насыщенных и ненасыщенных углеводородов»
- •Содержание
- •1 Техника безопасности
- •1.1 Общие праВила безопасности работы в лАборатОриЯх во врЕмЯ занЯтий с учАщимися [1]
- •1.2 Требования бЕзопаСнОсти при работе с киСлОтами и щелочами [1]
- •Растворять твердые щелочи следует путем медленного прибавления их небольшими кусочками к воде при непрерывном перемешивании. Кусочки щелочи нужно брать только щипцами.
- •1. 3 Правила бЕзопаСнОсти рАбОты с легковоспламенЯющимися и горючими жидкостями [1]
- •1.4 Требования безопасности при работе со Щелочными металлами [1]
- •1.5 Правила безопаснОй рабоТы с использованием спиртовОго и СухОго гОРючего [1]
- •1.6 ПрАвила безопасности работы с хИмической посудОй и ампулами [1]
- •2 Лабораторная химическая посуда
- •3 Применение хромовой смеси для мытья химической посуды
- •4.1 Сравнительная характеристика химических свойств алифатических соединений
- •4.1.1 Окисление
- •4.1.1.1 Реакции с KmnO4
- •4.1.1.2 Реакции с бромной водой
- •4.1.1.3 Реакции с аммиачным раствором оксида серебра (реактив Толленса)
- •Алкены и алкины с аммиачным раствором оксида серебра реагируют по механизму нуклеофильного замещения (sn).
- •Аналогично протекает реакция между алкинами и аммиачным раствором хлорида меди (I):
- •4.1.2 Термическое разложение (крекинг)
- •При повышенных температурах все углеводороды разлагаются с разрывом с – с связи (расщепление) и с – н связи (дегидрирование).
- •При каталитическом крекинге разрушение молекулы алканов происходит гетеролитически с образованием ионов карбония.
- •4.1.3 Гидратация (присоединение воды)
- •Алкины в присутствии серной кислоты и сульфата двухвалентной ртути легко присоединяют воду с образованием уксусного альдегида:
- •4.1.4 Гидрогалогенирование (присоединение галогеноводородов)
- •4.1.5 Реакции замещения
- •4.1.7 Полимеризация
- •Мономер димер тример … октамер полимер
- •Радикальная цепная реакция полимеризации
- •Катионная цепная реакция полимеризации
- •Анионная цепная реакция полимеризации
- •Изотактический (стереорегулярный)
- •АТактический (Нерегулярная стереоструктура)
- •СопОлимеризация
- •Реакция тепломеризации
- •5 Лабораторная работа
- •6 Оформление тетради
- •Контрольные вопросы
- •Литература
4.1 Сравнительная характеристика химических свойств алифатических соединений
4.1.1 Окисление
Все углеводороды горят с образованием СО2 и Н2О.
4.1.1.1 Реакции с KmnO4
Алканы при комнатной температуре очень стойки к действию обычных окислителей (KmnO4, K2Cr2O7).
Алкены и алкадиены с изолированными и куммулированными двойными связями при комнатной обесцвечивают раствор KmnO4:
![]()
Вероятный механизм реакции:
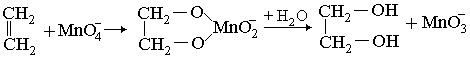
3MnO3– + H2O 2MnO2 + MnO4– + 2OH–
а
![]()
4.1.1.2 Реакции с бромной водой
алканы с бромной водой не реагируют. С галогенами реакция протекает только на свету или при нагревании – реакция замещения по радикальному механизму (SR).
Взаимодействие с галогенами. На свету, в темноте при нагревании (250–400° С) или в присутствии катализаторов (хлориды меди, сурьмы, олова или иод) газообразный хлор последовательно замещает в молекуле метана все четыре атома водорода с образованием галогенпроизводных:
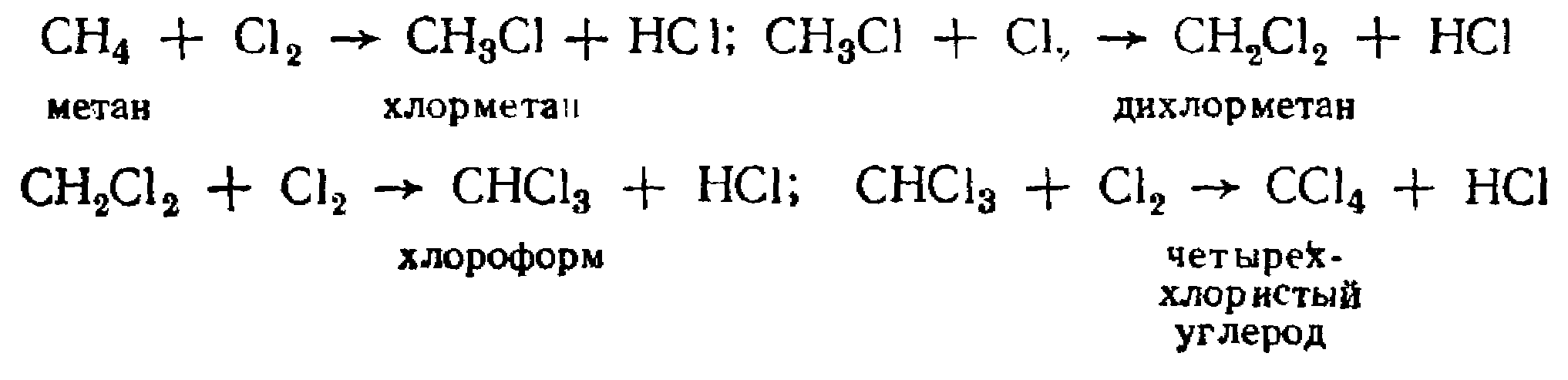
На практике при галогенировании алканов образуется сложная смесь продуктов, это связано с суммарным действием всех перечисленных ранее факторов. Так, при галогенировании изобутана образуются:
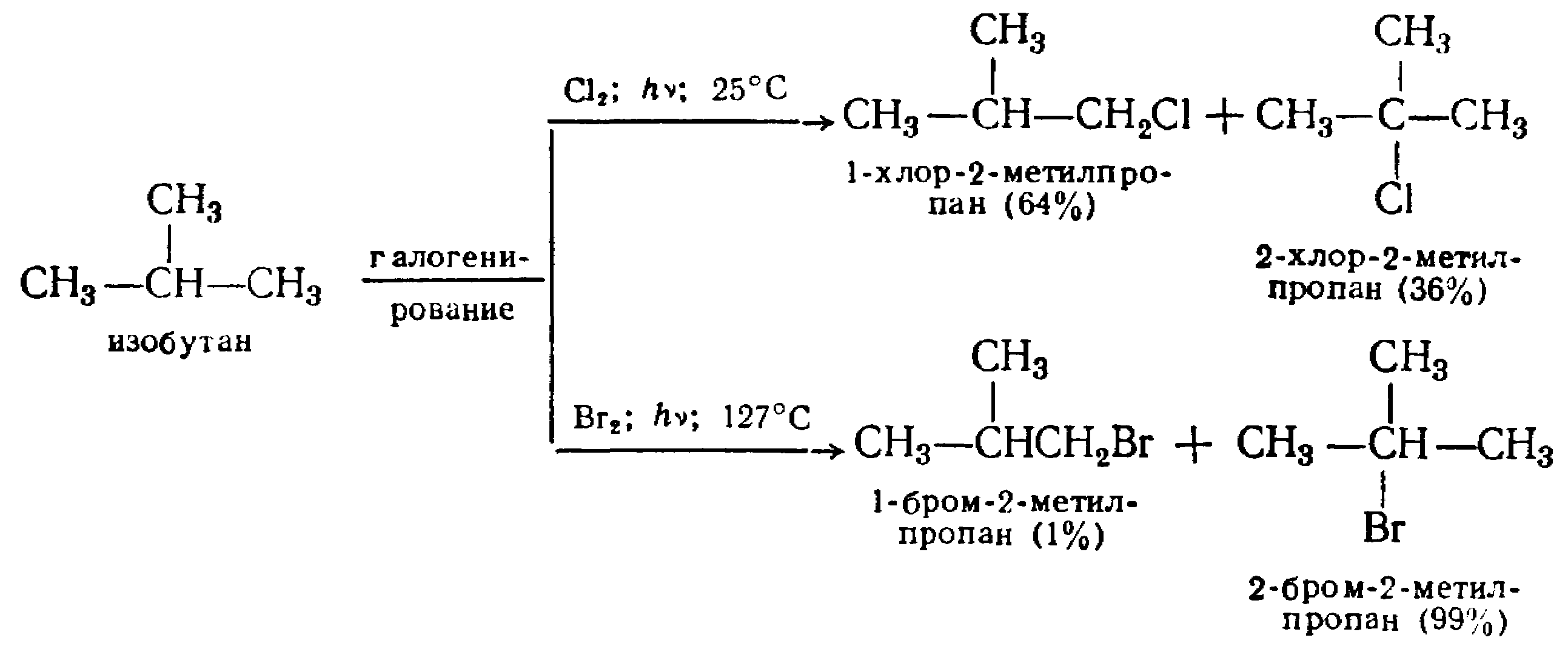
Кроме того, нужно помнить, что вероятность замещения девяти атомов водорода при первичных углеродных атомах больше, чем замещение одного водородного атома у третичного углерода. Хлорирование в присутствии катализаторов протекает по цепному ионному механизму:
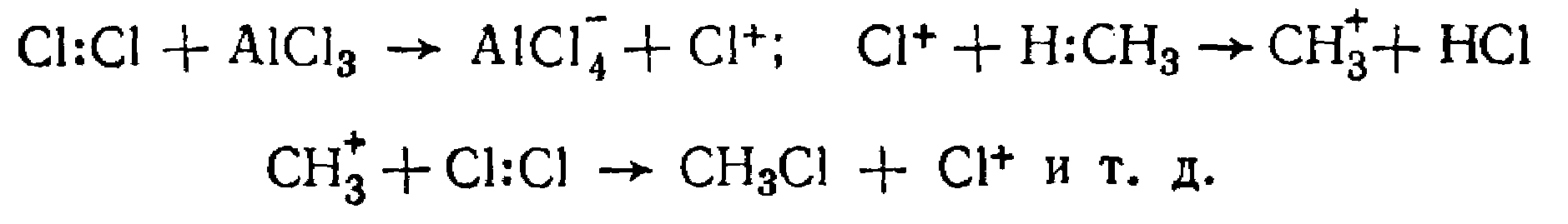
В лабораторной практике обычно не применяют прямое галогенирование для получения галогенпроизводных алканов, в технике значительное применение нашло галогенирование метана для синтеза СН3С1; СН2С12; СНС13 и CС14.
алкены и алкины обесцвечивают бромную воду. Происходит присоединение по ионному электрофильному механизму (АЕ). Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый -комплекс. Затем отделяется отрицательный ион галогена.
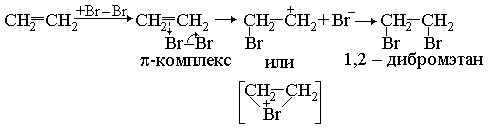
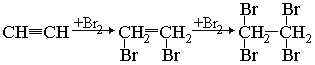
этин 1,2-дибромэтилен 1,1,2,2-тетрабромэтилен
4.1.1.3 Реакции с аммиачным раствором оксида серебра (реактив Толленса)
Для приготовления реактива Толленса смешивают растворы NaOH и AgNO3, в результате чего выпадает осадок Ag2O:
2AgNO3 + 2NaOH Ag2O + 2NaNO3 + H2O
бурый
осадок
При осторожном добавлении водного раствора аммиака осадок растворяется и образуется ион [Ag(NH3)2]+:
Ag2O + 4NН4NO3 [Ag(NH3)2]ОН + H2O
аммиачный раствор
оксида серебра
алканы с аммиачным раствором оксида серебра не реагируют.
Алкены и алкины с аммиачным раствором оксида серебра реагируют по механизму нуклеофильного замещения (sn).
СН СН + 2[Ag(NH3)2]ОН Ag–С С–Ag + 4NH3 + 2H2O
ацетиленид
серебра
СН = СН + 2[Ag(NH3)2]ОН Ag–С = С–Ag + 4NH3 + 2H2O
Внимание!!!! В большинстве учебников отмечается, что эта реакция характерна лишь для алкинов с концевой тройной связью.
