
- •Коллигативные свойства растворов
- •1Понятие раствор
- •2Образование растворов. Растворимость
- •2.1Растворимость газов в газах
- •2.2Растворимость газов в жидкостях
- •2.3Взаимная растворимость жидкостей
- •2.4Растворимость твердых веществ в жидкостях
- •3Растворы неэлектролитов
- •3.1Давление насыщенного пара разбавленных растворов
- •3.2Давление пара идеальных и реальных растворов
- •3.3Температура кристаллизации разбавленных растворов
- •3.4Температура кипения разбавленных растворов
- •3.5Осмотическое давление разбавленных растворов
- •3.6Понятие активности растворенного вещества
- •3.7Коллигативные свойства растворов
- •4Вопросы для самоподготовки к коллоквиуму
- •5Лабораторная работа 3.1. Исследование свойств растворов методом криометрии
- •Библиографический список
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«Санкт-Петербургский государственный университет
технологии и дизайна»
Кафедра теоретической и прикладной химии
Коллигативные свойства растворов
Методические указания для студентов, очной формы обучения
по специальности 260904.65 (281000) Технология кожи и меха
Составители:
С.Ф. Гребенников
Р. И. Ибрагимова,
Санкт-Петербург
2
 009
009
УТВЕРЖДЕНО
на заседании кафедры
18 сентября 2008 г.,
протокол № 1
Рецензент:
Н.В. Воробьев-Десятовский
В методических указаниях приведены краткие теоретические сведения по теме, вопросы для подготовки к теоретическому коллоквиуму, а также методика выполнения и расчета лабораторной работы по данной теме. Методические указания соответствуют программе по физической химии для студентов очной формы обучения по специальности 260904.65 (281000) Технология кожи и меха.
Оригинал подготовлен автором и печатается в авторской редакции.
Подписано в печать 29. 12. 2008 Формат 60х84 1/16.
Печать трафаретная. Усл. печ. л. 0,7. Тираж 60 экз.
Заказ .
Электронный адрес: organika@sutd.ru
Отпечатано в типографии СПГУТД
1 91028,
Санкт-Петербург, ул. Моховая, 26
91028,
Санкт-Петербург, ул. Моховая, 26
1Понятие раствор
Существование абсолютно чистых веществ невозможно – всякое вещество обязательно содержит примеси, или, иными словами, всякая гомогенная система многокомпонентна. Если имеющиеся в веществе примеси в пределах точности описания системы не оказывают влияния на изучаемые свойства, можно считать систему однокомпонентной; в противном случае гомогенную систему считают раствором.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
Раствор может иметь любое агрегатное состояние; соответственно их разделяют на твердые, жидкие и газообразные (последние обычно называют газовыми смесями). Обычно компоненты раствора разделяют на растворитель и растворенное вещество. Как правило, растворителем считают компонент, присутствующий в растворе в преобладающем количестве либо компонент, кристаллизующийся первым при охлаждении раствора; если одним из компонентов раствора является жидкое в чистом виде вещество, а остальными – твердые вещества либо газы, то растворителем считают жидкость. С термодинамической точки зрения это деление компонентов раствора не имеет смысла и носит, поэтому условный характер.
Одной из важнейших характеристик раствора является его состав, описываемый с помощью понятия концентрация раствора. Ниже дается определение наиболее распространенных способов выражения концентрации и формулы для пересчета одних концентраций в другие, где индексы А и В относятся соответственно к растворителю и растворенному веществу.
Молярная концентрация М – число молей νВ растворенного вещества в одном литре раствора.
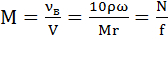 ,
,
где V – объем раствора (л); - плотность раствора (кг/л); - процентная концентрация (%); Mr – молекулярная масса растворенного вещества (г-моль); N – нормальность (нормальная концентрация, г-экв/л); f - фактор эквивалентности (экв).
Нормальная концентрация N – число молей эквивалентов растворенного вещества (равное числу молей νВ, умноженному на фактор эквивалентности f) в одном литре раствора:
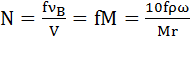 .
.
Моляльная концентрация m – число молей растворенного вещества В в одном килограмме растворителя.
Процентная концентрация ω – число граммов растворенного вещества в 100 граммах раствора:
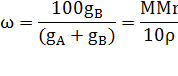
где
![]() – масса растворителя (г);
– масса растворителя (г); ![]() - масса растворенного вещества (г).
- масса растворенного вещества (г).
Еще
одним способом выражения концентрации
является мольная доля X - отношение числа
молей данного компонента (![]() )
к общему числу молей всех компонентов
в системе:
)
к общему числу молей всех компонентов
в системе:
 .
.
