
- •Основы радиационной экологии
- •Введение
- •1 Основные понятия, термины и определения
- •2 Из чего сделано вещество. Немного истории
- •2.1 Атомы
- •2.2 Элементарные частицы
- •2.3 Кварки
- •3 Элементарные частицы
- •3.1 Фундаментальные взаимодействия
- •3.2 Аннигиляция
- •4.1 Состав атомных ядер
- •4.2 Изотопы
- •4.3 Атом водорода
- •4.4 Дефект массы
- •4.5 Постулаты Бора
- •4.6 Корпускулярно-волновой дуализм
- •4.7 Энергия связи ядер
- •4.7.1 Энергетические уровни ядра
- •4.7.2 Насыщение ядерных сил
- •4.7.3 Импульс движения
- •4.7.4 Магнетон Бора
- •4.7.5 Спин ядра
- •4.8 Единицы атомной и ядерной физики
- •5 Радиоактивность
- •5.1 Естественная радиоактивность
- •5.2 Превращения ядерных частиц
- •5.7.1 Устойчивость ядер
- •5.3 Закон радиоактивного распада
- •5.4 Ядерные реакции
- •5.4.1 Первая ядерная реакция
- •5.4.2 Ядерные реакции под действием α- частиц
- •5.4.3 Ядерные реакции под действием протонов
- •5.4.4 Ядерные реакции под действием нейтронов
- •5.4.5 Реакция деления тяжелых ядер
- •5.4.5.1 Цепная реакция
- •5.4.5.2 Критическая масса
- •5.4.5.3 Ядерные реакторы
- •5.5 Синтез атомных ядер
- •5.5.1 Протон - протонная реакция
- •5.5.2 Углеродно – азотный цикл
- •5.5.3 Управляемый термоядерный синтез
- •6 Проявление радиоактивности
- •6.1 Ионизация
- •6.1.1 Потенциал ионизации
- •6.2 Взаимодействие ионизирующего излучения с веществом
- •6.2.1 Радиолиз воды
- •8.2.2 Свободные радикалы
- •6.3 Наведенная радиоактивность
- •Дозиметрия радиационных явлений
- •7.1 Радиоактивность, единицы измерения
- •7.2 Доза излучения
- •6.2.1 Экспозиционная доза
- •6.2.2 Поглощенная доза
- •6.2.3 Эквивалентная доза
- •6.2.4 Мощность дозы
- •8 Дозиметрия ионизирующих излучений
- •8.1 Детекторы ионизирующих излучений
- •8.1.1 Ионизационные камеры
- •8.1.1.1 Газоразрядные счетчики
- •8.1.2 Химические детекторы
- •8.1.3 Сцинтилляционные счетчики
- •8.1.4 Фотографические детекторы
- •8.1.6 Другие виды детекторов
- •8.2 Дозиметрические приборы
- •8.2.1 Некоторые дозиметрические приборы старшего поколения
- •8.2.2 Современные дозиметрические приборы
- •8.2.2.1 Многофункциональные приборы для контроля альфа, бета, гамма и нейтронного излучения
- •8.2.2.2 Приборы для контроля альфа - излучения
- •8.2.2.3 Приборы для контроля гамма – излучения
- •8.2.2.4 Системы индивидуальной дозиметрии
- •8.2.2.5 Приборы радиационного дозиметрического контроля
- •8.2.2.6 Радиометры
- •Приборы ветеринарного контроля
- •8.2.2.8 Системы радиационного контроля и мониторинга
- •8.2.2.9 Приборы радиационного контроля общего назначения
- •Заключение
- •Литература
- •Содержание
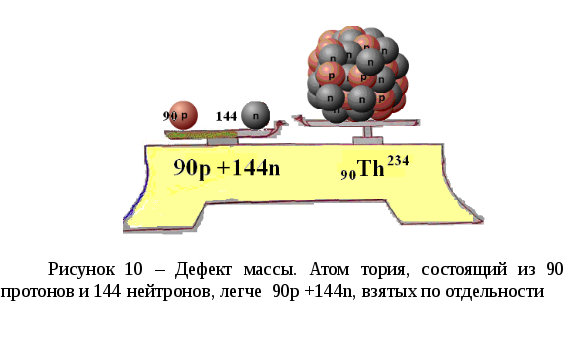
4.4 Дефект массы
Дефект масс - разность между массой атома данного изотопа, выраженной в атомных единицах массы, и массовым числом, равным числу нуклонов в ядре данного изотопа. ΔM = Zmp + Nmn – Mя. Различие масс обусловлено появлением энергии связи между нуклонами в ядре и характеризует устойчивость данного ядра. Иногда пользуются дефектом масс, отнесённым к одному нуклону, называемому упаковочным множителем. На рисунке 10 показано, что масса нуклонов составляющих ядерную систему меньше массы тех же нуклонов, не объединенных в ядро.
Нуклоны (протоны и нейтроны) в ядре прочно удерживаются ядерными силами. Чтобы удалить нуклон из ядра, надо совершить большую работу, т. е. сообщить ядру значительную энергию. Под энергией связи ядра понимают энергию, которая необходима для полного расщепления ядра на отдельные нуклоны. На основании закона сохранения энергии можно утверждать, что энергия связи равна энергии, которая выделяется при образовании ядра из отдельных частиц. Энергия связи атомных ядер очень велика по сравнению с энергией связи электронов с атомным ядром.
Определить энергию связи ядра можно, зная массу ядра и массы частиц — протонов и нейтронов, из которых оно состоит. Энергия связи ядер вычисляется с помощью известного соотношения Эйнштейна для связи энергии Е и массы m: E = Δm*c2 (где с - скорость света) и равна произведению дефекта массы (т. е. суммарной массы свободных нуклонов минус масса ядра) на квадрат скорости света.
4.5 Постулаты Бора
В основу квантовой теории атома Бор положил 2 постулата, характеризующих те свойства атома, которые не укладывались в рамки классической физики. Эти постулаты Бора могут быть сформулированы следующим образом:
1. Существование стационарных состояний. Атом не излучает и является устойчивым лишь в некоторых стационарных (неизменных во времени) состояниях, соответствующих дискретному (прерывному) ряду «дозволенных» значений энергии E1, E2, E3, E4,... Любое изменение энергии связано с квантовым (скачкообразным) переходом из одного стационарного состояния в другое.
2. Условие частот излучения (квантовых переходов с излучением). При переходе из одного стационарного состояния с энергией Ei в другое с энергией Ek атом испускает или поглощает свет определённой частоты v в виде кванта излучения (фотона) hv, согласно соотношению hv = Ei - Ek. При испускании атом переходит из состояния с большей энергией Ei в состояние с меньшей энергией Ek, при поглощении, наоборот, из состояния с меньшей энергией Ek в состояние с большей энергией Ei.
При испускании или поглощении света изменяется энергия атома, это изменение равно энергии испущенного или поглощённого фотона, т. е. имеет место закон сохранения энергии. Линейчатый спектр атома является результатом дискретности возможных значений его энергии.
Для определения дозволенных значений энергии атома — квантования его энергии — и для нахождения характеристик соответствующих стационарных состояний Бор применил классическую механику. Для простейшего атома — атома водорода, состоящего из ядра с зарядом +е (протона) и электрона с зарядом -e, Бор рассмотрел движение электрона вокруг ядра по круговым орбитам. Сравнивая энергию атома Е со спектральными термами Tn = R/n2 для атома водорода, найденными с большой точностью из частот его спектральных линий, он получил возможные значения энергии атома En = -hTn = -hR/n2(где n = 1, 2, 3,...). Они соответствуют круговым орбитам радиуса аn = а0n2, где a0 = 0,53·10-8 см — боровский радиус — радиус наименьшей круговой орбиты (при n = 1). Бор вычислил частоты обращения v электрона вокруг ядра по круговым орбитам в зависимости от энергии электрона. Оказалось, что частоты излучаемого атомом света не совпадают с частотами обращения vn, как этого требует классическая электродинамика, а пропорциональны, согласно соотношению hv = Ei - Ek, разности энергий электрона на двух возможных орбитах.
Бору удалось также не только объяснить спектр водорода, но и убедительно показать, что некоторые спектральные линии, которые приписывались водороду, принадлежат гелию. Предположение Бора о том, что результаты квантовой и классической теорий должны совпадать в предельном случае малых частот излучения, представляло первоначальную форму т. н. принципа соответствия.
