
- •Условные обозначения
- •Краткие сведения об основных термодинамических величинах
- •Химическое равновесие
- •Принципы определения термодинамических параметров химических реакций
- •Определение термодинамических параметров реакций модификации полимеров с использованием модельных превращений
- •Модификация карбоцепных ненасыщенных полимеров
- •Галобутилкаучуки
- •Гидрированные каучуки
- •Эпоксидированные каучуки
- •Присоединение меркаптанов
- •Модификация насыщенных карбоцепных полимеров
- •Хлорированный полиэтилен
- •Хлорсульфированный полиэтилен
- •Поливиниловый спирт
- •Модификация природных полимеров
- •Тринитроцеллюлоза
- •Триацетат целлюлозы
Государственное образовательное учреждение
высшего профессионального образования
«Казанский государственный технологический университет»
Кафедра технологии синтетического каучука
«Химическая термодинамика процессов модификации полимеров»
Тексты лекций
Самуилов Я.Д., Самуилов А.Я.
Казань 2010 г.
СОДЕРЖАНИЕ
Условные обозначения Краткие сведения об основных термодинамических величинах |
1 |
Химическое равновесие |
5 |
Принципы определения термодинамических параметров химических реакций |
12 |
Определение термодинамических параметров реакций модификации полимеров с использованием модельных превращений |
16 |
Модификация карбоцепных ненасыщенных полимеров |
19 |
Галобутилкаучуки |
19 |
Гидрированные каучуки |
28 |
Эпоксидированные каучуки |
37 |
Присоединение меркаптанов |
45 |
Модификация насыщенных карбоцепных полимеров |
51 |
Хлорированный полиэтилен |
51 |
Хлорсульфированный полиэтилен |
56 |
Поливиниловый спирт |
59 |
Модификация природных полимеров |
63 |
Тринитроцеллюлоза |
63 |
Триацетат целлюлозы |
66 |
Условные обозначения
U – внутренняя энергия
Н – энтальпия
S – энтропия
F – свободная энергия Гельмгольца
G – свободная энергия Гиббса
Т – температура
Р – давление
Кр – константа равновесия химической реакции
Ср - теплоемкость при постоянном давлении
ΔGr – свободная энергия Гиббса реакции
ΔНr – энтальпия реакции
ΔSr –энтропия реакции
ΔСр –разность теплоемкостей при постоянном давлении продуктов реакции и реагентов
Все величины U, H, F, G, ΔGr, ΔНr в настоящем пособии приведены в ккал/моль. Величины S, ΔSr, Cp, ΔСр приведены в кал/К·моль.
Краткие сведения об основных термодинамических величинах
Основными термодинамическими величинами, используемыми при описании термодинамики химических превращений, являются внутренняя энергия, энтальпия, энтропия, свободная энергия Гельмгольца, свободная энергия Гиббса.
Внутренняя энергия изолированной молекулы химического соединения (U) – это потенциальная энергия химического соединения. При образовании химического соединения из ядер атомов и электронов выделяется или поглощается энергия. Внутренняя энергия включает в себя все виды энергии, связанные со строением системы, и не включает кинетическую энергию. Внутренняя энергия химического соединения определяется не только кулоновскими взаимодействиями ядро-ядро, ядро-электрон, электрон –электрон, но включает в себя и энергию коррелированного движения электронов в молекулах. Если соединение находится в жидкой или твердой фазе, то внутренняя энергия увеличивается на величину теплоты испарения или кристаллизации (теплоту фазового перехода).
Энтальпия (Н) – запас энергии системы в виде теплоты. Она связана с внутренней энергией уравнением:
H = U + PV,
где V- объем, занимаемый веществом, Р – давление, под которым находится вещество в данном объеме. Если вещество находится в конденсированной фазе или в растворе, то величины внутренней энергии и энтальпии для этого вещества практически совпадают.
Энтропия (S) – термодинамическая функция, количественно характеризующая степень беспорядка в системе. Она является количественной мерой движения молекул химического соединения. Молекулы могут двигаться в пространстве поступательно по трем осям координат (молекулы имеют три поступательные степени свободы движения). Нелинейные молекулы могут вращаться независимо по трем осям координат (имеют три вращательные степени свободы движения). Атомы в молекулах колеблются друг относительно друга. В соответствии с этими формами движения различают поступательную, вращательную и колебательную энтропии. Общая энтропия соединения складывается из указанных отдельных составляющих.
Внутренняя энергия, энтальпия и энтропия являются функциями состояния системы. Функциями состояния называют такие функции, изменение которых зависит только от начального и конечного состояний системы и не зависит от пути перехода системы из начального состояния в конечное.
Внутренняя энергия и энтальпия измеряются либо в кал/моль, либо в Дж/моль. Энтропия измеряется в кал/К·моль или в Дж/Кмоль.
Свободная энергия Гельмгольца (F) – функция состояния системы, характеризующая протекание химических процессов в изохорно-изотермических условиях, т.е. при постоянном объеме реакционной смеси и при постоянной температуре.
Свободная энергия Гиббса (G) – функция состояния системы, характеризующая протекание химических процессов в изобарно-изотермических условиях, т.е. при постоянном давлении и постоянной температуре.
Энергии Гельмгольца и Гиббса измеряются в кал/моль или Дж/моль.
Между свободной энергией Гельмгольца и внутренней энергией и энтропией существует взаимосвязь:
F = U + TS.
Между свободной энергией Гиббса и энтальпией и энтропией осуществляется следующая взаимосвязь:
G = H + TS.
Важное значение в термодинамике имеет понятие химического потенциала. Химический потенциал определяют как первую производную свободной энергии Гиббса по количеству вещества (n) при постоянном давлении и температуре, или как первую производную свободной энергии Гельмгольца по количеству вещества (n) при постоянном объеме и температуре. Химический потенциал обозначают символом . В соответствии с приведенными определениями химический потенциал соединения равен:
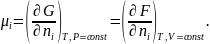
Химический потенциал показывает, как меняется свободная энергия вещества при изменении его количества. Количество вещества в химии часто выражают в молях.
Из приведенного выше уравнения следует, что:

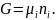
Из последнего уравнения видно, что если известен химический потенциал химического соединения, то легко определить энергию Гиббса или Гельмгольца любого количества вещества.
Равновесия в химических процессах достигаются тогда, когда химические потенциалы реагентов и продуктов реакции становятся равными. Поэтому понятие химического потенциала становится незаменимым при описании химических равновесий.
