
- •Термодинамика биологических систем Методическое пособие для самостоятельной работы студентов
- •Содержание
- •Термодинамика биологических систем
- •Основные термины термодинамики
- •Свободная энергия
- •Применение первого начала термодинамики к живым системам (организмам) (Различие термодинамических процессов в живой и неживой системах)
- •Закон гесса
- •Второй закон термодинамики
- •Второй закон термодинамики и живой организм.
- •Стационарное состояние
- •Теорема пригожина
- •Биофизические основы терморегуляции тепловой баланс организма
- •Список литературы
Второй закон термодинамики и живой организм.
В течение длительного времени считали, что второй закон термодинамики неприменим к биологическим системам, т. к. согласно этому закону в системах могут происходить лишь процессы, связанные с рассеянием энергии. Живые же организмы способны накапливать богатые энергией соединения, т.е. создавать более упорядоченную структуру и энтропию не увеличивать. Это несоответствие объясняется тем, что закон классической термодинамики справедлив для изолированных систем, а живые организмы являются открытыми системами. Живые структуры непрерывно разрушаются и вновь восстанавливаются, их постоянство заключается только в том, что процессы распада и обновления точно компенсируют друг друга. Состояние, при котором распад уравновешивается синтезом, называется динамическим равновесным состоянием.
С точки зрения термодинамики жизнь – невероятное состояние (феномен). И опять здесь нет противоречия, т. к. организм неизолированная система! Если изолировать биологический объект, лишить его пищи, воздуха, то энтропия такой системы возросла бы, и все закончилось смертью.
В процессе прекращения связи системы с окружающей средой резко возрастает неупорядоченность системы и увеличивается энтропия. Таким образом, обмен веществ позволяет сохранить или даже повысить упорядоченность организма и, соответственно, сохранять или уменьшать его энтропию. Поэтому общее изменение системы можно представить в виде двух составляющих: dS=dSi + dSe,
где dSi – изменение энтропии вследствие необратимости процессов в биохимической системе;
dSe – изменение энтропии, обусловленное взаимодействием биологической системы с окружающей средой (т.е. получение продуктов питания и выведения продуктов жизнедеятельности). Если внутри биологических систем протекают обратимые процессы, то они не сопровождаются возникновением энтропии dSi=0. Для всех случаев необратимых изменений dS>0. В изолированной системе обмен со средой не происходит, то есть dSe=0. И потому dS=dSi>0, что соответствует классической формулировке второго закона термодинамики для изолированных систем. В открытых системах в разные промежутки времени изменение полной энтропии может быть различным, т. к. постоянно изменяются величины dSi и dSe. В связи с этим в термодинамике открытых систем был введен новый параметр – время и тогда
dS/dt=dSi/dt+dSe/dt,
член dSi/dt – называется продукция энтропии, а dSe/dt – потоком энтропии. Это уравнение является математическим выражением второго закона термодинамики для живых организмов. Он гласит : «Скорость изменения энтропии организме dS/dt равна алгебраической сумме скорости возникновения энтропии внутри системы (продукция энтропии dSi/dt) и скорости обмена энтропии между организмом и окружающей средой (поток энтропии dSe/dt)».
Стационарное состояние
Стационарным состоянием называется такое состояние системы, при котором параметры системы не меняются со временем на фоне протекающих процессов обмена с окружающей средой. В таком состоянии и энтропия S постоянна, а следовательно
dS=dSi+dSe=0,
то есть dSi=-dSe и dSi/dt=-dSe/dt
– это уравнение является уравнением стационарного состояния. Сходство стационарного состояния и термодинамического равновесия заключается в том, что параметры системы не меняются во времени как в одном, так и в другом случае. Но постоянство параметров при стационарном состоянии достигается не в результате отсутствия всяких направленных процессов, как при термодинамическом равновесии, а в результате того, что процессы протекают, но скорость направления этих процессов постоянна и взаимно уравновешивается.
В состоянии равновесия в системе прекращаются все процессы, кроме теплового движения молекул; соответственно, выравниваются все градиенты.
В стационарном состоянии идут химические реакции, диффузии, перенос ионов и др. процессы, но они так сбалансированы, что состояние системы в целом не изменяется. Способность сохранять постоянство внутренней среды называется гомеостазисом или просто гомеостазом. Гомеостаз представляет собой стационарное состояние организма высших животных.
Характерным свойством живого организма помимо постоянства параметров являются также совершенно определённые реакции на внешнее воздействие, которые выводят организм из стационарного состояния.
Такие явления, как возбуждение, мышечное сокращение, генерация нервного импульса и другие, являются примерами переходных процессов между стационарными уровнями. При этом все уровни лежат в пределах биологических норм.
Если система выведена из стационарного состояния, то к новому стационарному состоянию она может переходить по-разному. Можно выделить три основных типа переходов.
 X
X
 2
2
-
 ----------------------------------------------В
----------------------------------------------В
1
 -----------------------------------------------А
3
t
-----------------------------------------------А
3
t
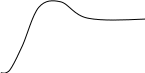
Типы перехода из одного стационарного состояния (А) в другое (В)
Х – значение параметра, характеризующего стационарное состояние;
t – время.
Кривая 1 изображает простой экспоненциальный переход от одного уровня стационарного состояния к другому. Такой переход характерен например для частоты дыхания и сердцебиения при равномерном изменении интенсивности физической работы (нагрузки).
Кривая 2 называется кривой с избыточными отклонениями (овершут), когда промежуточный уровень выше конечного. Такая кривая может характеризовать, например, изменения артериального давления крови человека при резком увеличении интенсивности физической работы.
Кривая 3 отражает такие изменения, когда уровень сначала понижается, а затем возрастает до конечного стационарного состояния. Этот тип называют «ложным стартом».
Приведённые кривые отражают переходные процессы только в первом приближении. Строго говоря, и переходные и стационарные процессы имеют колебательный характер.
