
- •Термодинамика биологических систем Методическое пособие для самостоятельной работы студентов
- •Содержание
- •Термодинамика биологических систем
- •Основные термины термодинамики
- •Свободная энергия
- •Применение первого начала термодинамики к живым системам (организмам) (Различие термодинамических процессов в живой и неживой системах)
- •Закон гесса
- •Второй закон термодинамики
- •Второй закон термодинамики и живой организм.
- •Стационарное состояние
- •Теорема пригожина
- •Биофизические основы терморегуляции тепловой баланс организма
- •Список литературы
Применение первого начала термодинамики к живым системам (организмам) (Различие термодинамических процессов в живой и неживой системах)
Классическая форма первого начала термодинамики отображает запросы теплотехники, интенсивно развивающиеся в эпоху открытия этого основного закона. Поэтому эта форма не вполне удобна для биологии, т.к. не отображает сути термодинамических процессов, происходящих в живых системах. В отличие от тепловых машин, живые организмы производят работу не за счёт тепловой энергии, а посредством использования химической энергии пищевых продуктов, усвоенных ими (Wпищи).
Поэтому для живой системы U = Wпища – Q – A (перед Q стоит знак «–», т.к. биологическая система отдаёт тепло окружающей среде).
Организм
гомойотермных животных имеет постоянную
температуру, химический состав его в
среднем не изменяется, поэтому U=const
и U=0.
Учитывая это, предыдущую формулу можно
записать так: 0 = Wпищи
– Q
– A
или
Wпищи
= Q
+ A,
если при этом помнить, что совершаемая
работа (АС)
и теплообмен (Q)
могут иметь разнообразные формы, то
получаем, что
Wпищи
=
![]() Q
+
A
Q
+
A
Эта форма наиболее точно отображает первое начало термодинамики для биологических систем.
Итак, термодинамические процессы в тепловой машине можно представить схемой (источник энергии на Земле – Солнце)
(неживая
система) Wc
![]() Wтоплива
Wтоплива![]() Q
U+A,
Q
U+A,
где в биологической системе
(живая
система) Wc
Wпищи
![]() U+A+Q
U+A+Q
Wc – энергия солнца Wt – энергия топлива Wn– энергия пищи.
В живой системе между Wc и последним значением A отсутствует промежуточное звено в форме тепловой энергии, следовательно, КПД живой системы выше, чем у неживой и достигает значения 20-60 %.
Таким образом, обмен веществ в организме сопровождается процессами превращения энергии. Обмен энергии и вещества представляет собой единый процесс, лежащий в основе жизнедеятельности. Живой организм расходует химическую энергию всех рабочих процессов, выполняемых в организме, и выделяет избыточное количество тепла (тепловой эффект).
Закон гесса
Следствием I закона термодинамики является з-н Гесса. Тепловой эффект химического процесса не зависит от промежуточных стадий и определяется лишь начальным и конечным состояниями термодинамической системы.
Иллюстрацией к закону Гесса является рис.
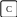

 Q1
Q2
Q1
Q2

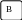
 Q
Q
Q= Q1+Q2
исходные продукты реакции;
конечные продукты реакции;
промежуточные продукты реакции.
Q
C + O2
=
CO2
+
97![]()
Q2 CO +1/2 O2 = CO2 + 68
Произведём вычисления Q – Q2 = Q1 , Q1 = (97- 68)=29 ,
то есть C + 1/2Q2 = CO + 29 , то есть величина теплового эффекта этой реакции равна 29 .
Закон Гесса позволяет вычислить тепловые эффекты таких реакций, которые совсем не протекают в условиях опыта, а также таких, для которых невозможно измерить тепловой эффект.
Например, неизвестен тепловой эффект реакции окисления углерода, т.к. при реакции всегда образуется некоторое количество СО2, но известны тепловые эффекты окисления С до СО2 и СО до СО2.
Биохимические реакции организма очень сложные и имеют много промежуточных стадий, которые не всегда известны. Однако, на основании закона Гесса, зная начальный и конечный продукты реакции, можно рассчитать тепловой эффект сложной биохимической реакции. Закон Гесса используется также для вычисления калорийности пищевых продуктов. Хотя питательные вещества претерпевают в организме сложные превращения, энергетический эффект их равен тепловому эффекту непосредственного сжигания этого продукта в калориметрической бомбе, поскольку в обоих случаях начальные и конечные состояния реагирующих веществ одинаковы (т.е., грубо говоря, можно определить калориметрическую стоимость пищи). Энергозатраты организма определяются с помощью прямой или непрямой калориметрии.
