- •Ізомеризація алканів:
- •Електроліз по Кольбе:
- •Циклоалкани
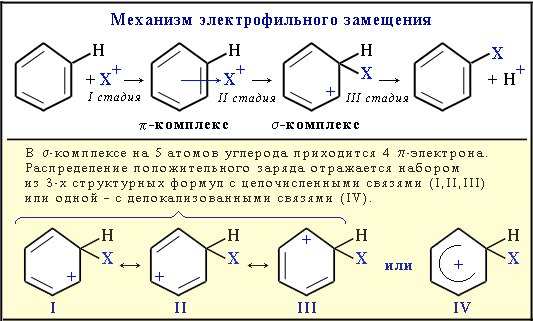
- •Механізм реакції електрофільного приєднання
- •Зсув подвійного зв’язку:
- •Алкадієни
- •Піроліз нафтопродуктів або горючих газів:
- •Взаємодія дигалогенопохідних алканів зі спиртовим розчином лугу.
- •Взаємодія солей ароматичних кислот і натронного вапна:
- •Багатоядерні арени
- •Правила заміщення в бензеновому ядрі
- •Галогенопохідні вуглеводнів
- •Заміщення Гідрогену вуглеводнів галогеном:
- •Приєднання галогенів і галогенводню до ненасичених вуглеводнів:
- •Заміщення гідроксильної групи спирту атомом галогену:
- •Окремі представники галогенпохідних вуглеводнів
Піроліз нафтопродуктів або горючих газів:
![]()
![]()
Прямий синтез алкінів з Гідрогену і Карбону (П.Бертло, 1862) широко використовується в промисловості.
Гідроген пропускають в полум’я електричної дуги між двома вугільними електродами:
2С + 2Н → СН ≡ СН
Взаємодія дигалогенопохідних алканів зі спиртовим розчином лугу.
Використовують дигалогенопохідні алканів, у молекулах яких є два атоми галогену біля одного карбонового або біля двох карбонових атомів:

Дія на ацетиленіди алкілгалогенідами ‑ подовження ланцюга (алкілування ацетиленідів) і утворення гомологів алкінів:
![]()
Арени
Арени (ароматичні вуглеводні) – органічні сполуки, молекули яких містять один або декілька циклів з шести атомів Карбону – бензенове кільце.
Ароматичні вуглеводні:
одноядерні;
двоядерні (з конденсованими і неконденсованими ядрами);
трьохядерні(з конденсованими і неконденсованими ядрами).
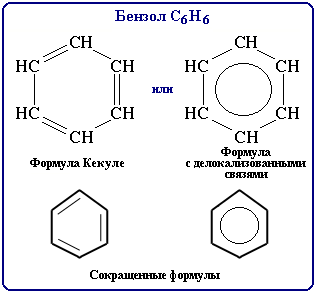
Бензол (бензен) є найпростішим ароматичним вуглеводнем: С6Н6
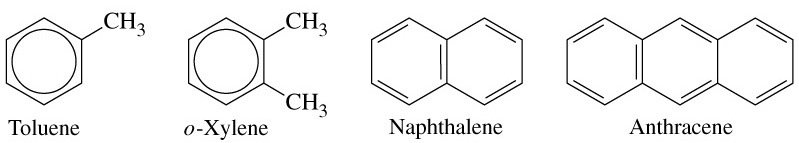
бензен метилбензен 1,2-диметилбензен нафтален антрацен
бензол толуол о-ксилол
толуен о- ксилен
Загальна формула гомологічного ряду ароматичних вуглеводнів: СnH2n-6
Гомологічний ряд одноядерних аренів: С6Н6; С7Н8; С8Н10; С9Н12; С10Н14
![]()
![]() алкілбензен
алкілбензен
Гомологи бензолу – ароматичні вуглеводні, в бензеновому кільці яких один або декілька атомів водню заміщені на алкільні радикали.
Номенклатура
Історична: толуен (метильне похідне), ксилен (диметильне похідне), кумен (ізопропілбензен), стирен (вінілбензен). Радикали аренів, які зустрічаються найчастіше, називають арилами: феніл С6Н5 ‑, толіл (о-, м-, п-) СН3 ‑ С6Н4 ‑, бензил С6Н5 – СН2 ‑, стирил С6Н5 – СН =СН ‑.
ІЮПАК: пронумеровані атоми Карбону ядра вказують положення замісників. Атоми Карбону в кільці нумерують, починаючи з атома, біля якого є замісник з найменшою кількістю атомів Карбону. Напрям нумерування такий, щоб інші замісники дістали найменші номери. При найменуванні дотримуються «старшинства» і додають префікси, позначаючи однакові радикали, потім пишуть слово «бензен».
Ізомерія
ізомерія радикалів:
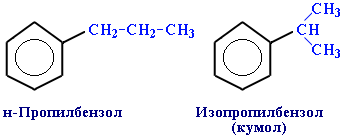
пропілбензен ізопропілбензен
ізомерія положення замісників в бензеновому ядрі (о-, м-, п-):
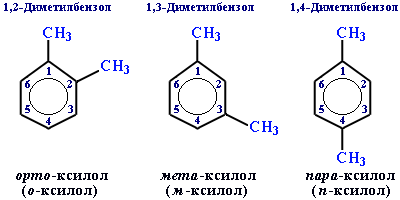
Будова
Будова молекули бензену, найчастіше відображається формулою Кекуле (1865):
|
Уявлення Ф.Кекуле про структуру бензену:
|
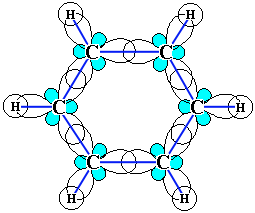
Методами молекулярних орбіталей і електронографії встановлено, що кожний атом С в ядрі бензену знаходиться в стані sp2-гібридизації. Всі атоми Карбону лежать в одній площині, кути, утворені зв’язками Н – С – С і С – С – С дорівнюють 1200. В ядрі бензену є по 6 σ-зв’язків між атомами С і атомами С і Н. Електронна хмара четвертого р-електрона, що не бере участі у гібридизації, має форму гантелі і зорієнтована перпендикулярно площині кільця. З 6 р-електронів утворюється єдина π-електронна система (шість делокалізованих орбіталей). Області найбільшої електронної густини розміщені по обидва боки площини π-зв’язку (6 π-зв’язків). Отже, формуються два нерозривних кільця електронної густини, які обумовлюють особливі хімічні властивості бензену та похідних аренів.
|
|
|
π-електронна хмара в молекулі бензолу |
Схема делокалізації π-електронів |
Sp2-гібридизація атомних орбіталей Карбону |
Система ароматична і спряжена. В ядрі аренів зв'язок С – С має високу стійкість до реакцій окислення, приєднання, заміщення. Саме це стало причиною внесення поправок в написання формули бензенового кільця, що відображено у вирівнюванні електронної густини в системі σ- і π - зв’язків.
Фізичні властивості
Бензен його гомологи – безбарвні з характерним змахом рідини, що заломлюють промені світла. Вищі гомологи бензену – тверді речовини. Арени нерозчинні у воді і добре розчиняються в органічних розчинниках, бензен, ксилени, толуен – органічні розчинники. Арени з бічним ланцюгом нормальної будови киплять при температурах, вищих за температуру кипіння ізомерів з бічним ланцюгом ізобудови.
Хімічні властивості
І. Реакції заміщення
Арени вступають переважно в реакції електрофільного заміщення, які відбуваються за іонним механізмом через утворення π- та σ-комплексів.
нітрування бензенового ядра:
![]()
нітробензен
Умови: концентровані Н2SO4 і НNO3.
![]()
Гомологи бензену нітруються легше:
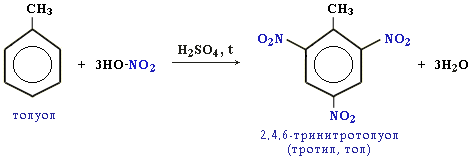
2,4,6-тринітротолуен (2,4,6-тринітро-1-метилбензен)
галогенування відбувається у присутності каталізаторів (FeCI3, AICI3, FeBr3, AIBr3). Хлор і бром здатні вступати в реакцію галогенування при кімнатній температурі:
Для гомологів бензену (атом галогену заміщується в положення 1 або 4).
![]()
сульфування відбувається при нагріванні арена з концентрованою Н2SO4:
С6Н6 + НОSO3H → C6H5 – SO3H + 2H2O
сульфобензен
алкілування (реакція Фріделя-Крафтса) – введення в молекулу арена радикалів або одержання з бензену його гомологів. Алкілування бензолу галоїдними алкілами в присутності каталізатора АІСІ3:
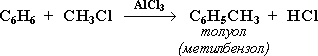
Алкілування бензолу алкенами (каталізатори АІСІ3, Н3РО4 або ВF3).
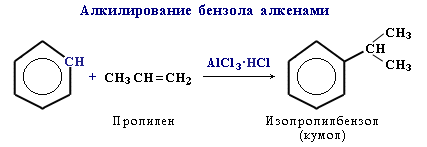 кумен
(кумол)
кумен
(кумол)
ІІ .Реакції приєднання
Арени важко вступають в реакції приєднання.
приєднання водню. Умови: каталізатори (Рt, Pd, Ni), нагрівання, підвищений тиск:

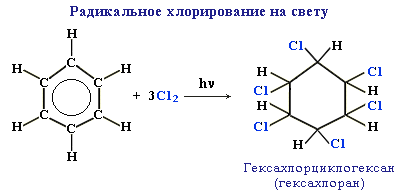
приєднання галогенів здійснюють при прямому сонячному світлі або УФ-випромінюванні, утворюється гексахлорциклогексан:
ІІІ. Реакції окислення
Бензенове кільце стійке до дії окисників: окислюється хромовою сумішшю в присутності каталізаторів (V2O5) і при високій температурі (350 – 4500С):
![]()
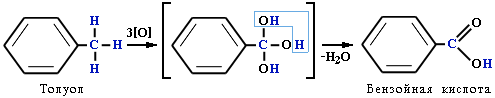
Толуен Бензойна кислота
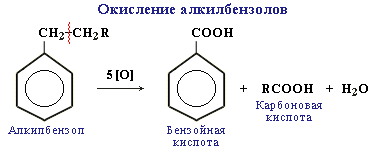
Гомологи бензену легко окислюються розчинами КМnO4, КСІО3 за бічним ланцюгом з утворенням альдегідів, кетонів і карбонових кислот:
ІV. Реакції замісників
Якщо реакцію галогенування проводити без каталізатора і при нагріванні або дії сонячного світла, відбувається заміщення Гідрогену в радикалі бокового ланцюга (реакція проходить за радикальним механізмом):
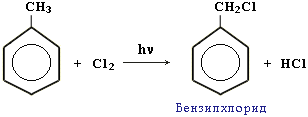
дегідрування (дегідрогенізація) аренів
Умови: при високих температурах (до 6000С), наявність каталізаторів (ZnO, Cr2O3, AI2O3):
С6Н5 – СН2 – СН3 → С6Н5 – СН = СН2 + Н2
етилбензен стирен
полімеризація
стирен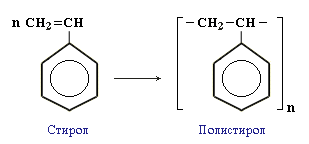 полістирен
(полістирол)
полістирен
(полістирол)
Методи одержання аренів
Метод дегідрування циклоалканів:
Метод дегідрування алканів з наступною циклізацією (каталізатори – оксиди хрому, молібдену і ванадію):
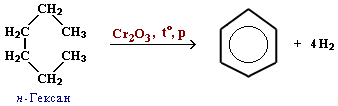
Реакція Вюрца – Фіттіга:
С6Н5І + 2Na + I CH3 → С6Н5 ‑ CH3 + 2NaI
метилбензен
Синтез Фріделя-Крафтса (1877) – спосіб одержання гомологів бензолу з хлоралкілу у присутності АІСІ3 (безводного):