
- •Тема: Теоретические основы аналитической химии Расчёт pH в водных растворах
- •Расчёты, основанные на произведении растворимости осадков
- •Тема: Качественный химический анализ
- •Качественные реакции на катионы и анионы
- •Зависимость цвета пламени от наличия соединений металлов
- •Действие групповых реактивов на катионы
- •Тема: Количественный анализ Примеры решения задач и тестовых заданий согласно закону эквивалентов
- •Примеры решения задач на приготовление растворов методом разбавления
- •Кислотно-основные индикаторы
- •Раствор имеет кислую реакцию, рН 7
- •Применение индикаторов при титровании
- •Важнейшие методы химического титриметрического анализа
- •Гравиметрический метод анализа
- •Физико-химические методы анализа
- •Оптические методы анализа
- •Методы разделения и концентрирования
- •Дидактическая единица 4. Физическая и коллоидная химия Тема заданий 15. Основы химической термодинамики
- •Тема заданий 16. Химическая кинетика и катализ
- •Тема заданий 17. Химическое равновесие
- •Тема заданий 18. Общие свойства растворов
- •Тема заданий 19. Электрохимические процессы. Гальванический элемент. Коррозия металлов
- •Тема заданий 20 . Электрохимические процессы. Электролиз
- •Дидактическая единица 3. Высокомолекулярные соединения Тема заданий 11. Органические и неорганические полимеры
- •Тема заданий 12. Методы получения полимеров
- •Тема заданий 3. Строение и свойства полимеров
- •Тема заданий 14. Биополимеры
Зависимость цвета пламени от наличия соединений металлов
ион |
цвет пламени |
ион |
цвет пламени |
Na + |
жёлтое окрашивание |
Ba2 + |
жёлто-зелёное окрашивание |
K + |
фиолетовое окрашивание |
Ca2 + |
кирпично-красное окрашивание |
Sr2+ |
карминово-красное окрашивание |
Cu2+ |
зелёное окрашивание |
Действие групповых реактивов на катионы
(кислотно-основная классификация)
Группа |
Катионы |
Групповой реагент |
Наблюдаемый эффект |
Реакции |
I |
Li+, Na+, K+, NH4+ |
нет |
- |
- |
II |
Ag+, Hg2+2, Pb2+. |
HCl |
AgCl↓. HgCl2↓. PbCl2↓ белый осадок. |
Ag++ Cl–→ AgCl↓ |
III |
Ca2+, Sr2+, Ba2+ |
H2SO4 |
Ca SO4↓, Sr SO4↓, BaSO4↓ белый осадок |
Ca2+ + SO4 2–→ Ca SO4↓, |
IV |
Zn2+, Al3+, Sn2+, Cr3+ |
NaOH |
выпадают осадки амфотерных гидроксидов, растворимые в избытке раствора NaOH |
Zn2–++2OH → Zn(OH)2 ↓ Zn(OH)2+ 2OH– (избыток) →[ Zn(OH)4] 2– |
V |
Mg2+, Fe2+, Fe3+ |
NaOH |
осадки гидроксидов, нерастворимые в избытке раствора NaOH, но растворимые в уксусной и минеральных кислотах. |
Mg 2+2OH → Mg (OH)2 ↓
|
VI |
Сu2+, Cd2+, Co2+, Ni2+ |
NH4OHконц |
выпадают осадки основных солей и гидроксид кобальта, растворимые в избытке группового реактива с образованием аммиачных комплексов |
СuCl2+ NH3H2O →CuOHCl↓+ NH4Cl CuOHCl↓+ NH3H2O(избыток) →[Cu(NH3)4]2++OH‾ + Cl‾ + H2O Cd2++OH-→ Cd(OH)2↓ Cd(OH)2 + 4 NH3 (избыток) → [Cd(NH3)4]2+ + 2ОН- |
|
|
Добавление Na2CO3 |
Na+, K+ - остаются в растворе; Al3+, Cr3+, Fe3+ - выпадают в виде гидроксидов; остальные катионы в виде карбонатов |
2Al3++3H2O +3Na2 CO3→Al(OH)3↓+6Na+ +CO2↑ 2Fe3++3H2O +3Na2 CO3→Fe(OH)3↓+6Na+ +CO2↑ 2Cr3++3H2O +3Na2 CO3→Cr(OH)3↓+6Na+ +CO2↑ Mg2+ + +Na2 CO3→ Mg CO3↓ +2Na+ Ca2+ +Na2 CO3→ CaCO3↓ +2Na |
Тема: Количественный анализ Примеры решения задач и тестовых заданий согласно закону эквивалентов
C1Э∙V1= C2Э∙V2
1. При сливании 20 мл 0,1 М раствора и 15 мл 0,2 М раствора образуется осадок массой _0,466 г.
Решение:
Уравнение
реакции имеет вид
![]() .
Согласно
формуле
.
Согласно
формуле
 ,
,
![]() ;
;
![]() –
в
избытке.
–
в
избытке.
![]() моль;
следовательно,
моль;
следовательно,
![]()
2. Масса гидроксида бария, содержащаяся в 500 см3 раствора, на титрование 25,0 мл которого израсходовано 15,0 мл раствора соляной кислоты с молярной концентрацией эквивалентов 0,01 моль/л, составляет 256,5мг.
Решение:
Уравнение
реакции имеет вид ![]()
Согласно
выражению закона эквивалентов
![]() и
по формулам:
и
по формулам:
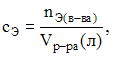
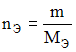 и
и
![]() получаем
получаем
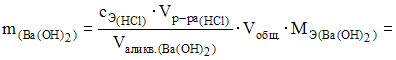
![]()
3. Для нейтрализации 25 мл раствора гидроксида бария было затрачено 15 мл соляной кислоты c молярной концентрацией эквивалентов 0,15 моль/л. Молярная концентрация эквивалентов раствора гидроксида бария равна 0,09 моль/л.
Решение:
Уравнение
реакции имеет вид
![]() Согласно
выражению закона эквивалентов для
данной реакции
Согласно
выражению закона эквивалентов для
данной реакции
![]()
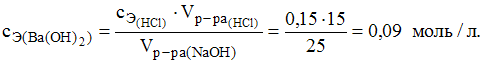
4. При определении содержания бромида калия в сточных водах на титрование аликвоты объемом 100 см3 было израсходовано 12,0 мл раствора нитрата серебра с молярной концентрацией 0,0125 моль/л. Содержание бромида калия в водах составляет 178,5 мг/л.
Решение:
Уравнение
реакции имеет вид
![]() Согласно
формулам:
Согласно
формулам:
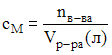 и
и
![]() получаем
получаем
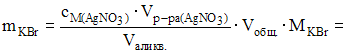
![]()
5. Объем раствора гидроксида бария с молярной концентрацией эквивалентов 0,1 моль/л, необходимый для нейтрализации 25 мл раствора соляной кислоты c молярной концентрацией эквивалентов 0,2 моль/л, равен 50 мл.
Решение:
Уравнение
реакции имеет вид ![]() .
Согласно
выражению закона эквивалентов для
данной реакции
.
Согласно
выражению закона эквивалентов для
данной реакции
![]() ,
,
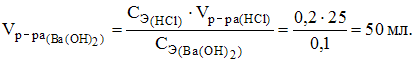
6. Объем 0,1 М раствора хлорида бария, необходимый для осаждения сульфат-ионов из 200 мл 0,025 М раствора серной кислоты, равен 50 мл.
Решение:
Уравнение
реакции имеет вид ![]() Согласно
выражению закона эквивалентов для
данной реакции
Согласно
выражению закона эквивалентов для
данной реакции
![]() ,
,

7. Объем 0,1 М раствора NaOH, необходимый для нейтрализации раствора соляной кислоты, содержащего 0,073 г HCl, равен 20 мл.
Решение:
На
основании уравнения реакции
![]()
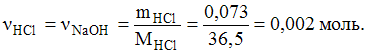 Согласно
формуле
,
Согласно
формуле
,
![]() .
.
8. Объем 0,1М раствора карбоната натрия, необходимый для осаждения ионов кальция из раствора, содержащего 0,324 г его гидрокарбоната, равен 20 мл.
Решение: Уравнение реакции имеет вид . Согласно формулам и , .
