
2. Аминокислоты – структурные компоненты белков
Для установления аминокислотного состава белков пользуются сочетанием кислотного (НС1), щелочного (Ва(ОН)2) и, реже, ферментативного гидролиза или одним из них. Установлено, что при гидролизе чистого белка, не содержащего примесей, освобождаются 20 различных аминокислот.
Аминокислоты, входящие в состав белков, являются a-аминокислотами. Все они принадлежат к L-ряду, а величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора. В белках человека D-аминокислоты не обнаружены, однако они встречаются в клеточной стенке бактерий, в составе некоторых антибиотиков (актиномицинов).
Аминокислоты отличаются друг от друга химической природой радикала R, который не участвует в образовании пептидной связи. Современная рациональная классификация аминокислот основана на полярности радикалов.
Выделяют: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (главным образом неполярные), 4) отрицательно заряженные и 5) положительно заряженные аминокислоты.
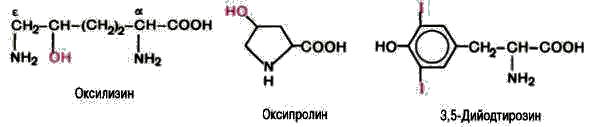
В некоторых белках обнаружены производные аминокислот. В белке соединительной ткани коллагене содержатся оксипролин и оксилизин. Дийодтирозин является основой структуры гормонов щитовидной железы.
Аминокислоты обладают общим свойством - амфотерностью (от греч amphoteros - двусторонний). В интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов (биполярных ионов). Значение ИЭТ аминокислоты рассчитывается по формуле:
![]()
Для моноаминодикарбоновых кислот рI рассчитывается как полусумма значений рК - и -карбоксильных групп, для диаминомонокарбоновых кислот – как полусумма значений рК - и -аминогрупп.
Существуют заменимые аминокислоты, которые могут синтезироваться в организме человека, и незаменимые, которые в организме не образуются и должны поступать с пищей.
Незаменимые аминокислоты: валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты: глицин, аланин, аспарагин, аспартат, глутамин, глутамат, пролин, серин.
Условно заменимые (могут синтезироваться в организме из других аминокислот): аргинин (из цитруллина), тирозин (из фенилаланина), цистеин (из серина), гистидин (при участии глутамина).
Содержание различных аминокислот в белках неодинаково.
Для открытия в биологических объектах и количественного определения аминокислот используют реакцию с нингидрином.
Белки - высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот, соединенных пептидными связями. Белки называют также протеинами (от греч. рrotos – первый). Свое название они получили, когда в тканях животных и растений были обнаружены вещества, имеющие сходство с белком куриного яйца.
Белки составляют основу и структуры, и функций живых организмов. Природные белки построены из 20 различных аминокислот. Эти аминокислоты могут объединяться в самой разной последовательности, поэтому они могут образовывать порядка 1018 разнообразных белков. Они обеспечивают существование около 106 видов живых организмов, начиная от вирусов и заканчивая человеком. Каждый организм характеризуется уникальным набором белков.
Содержание белков в различных тканях одного организма неодинаково. Так, в организме человека содержится белков в % от сухой массы: в мышцах – 80,в мозге – 45, в костях – 20.
Элементный состав белков в пересчете на сухое вещество: С - 50-54%; Н - 6,5-7,3%; О - 21-23%; N - 15-17%; S - до 0,5%.
В составе некоторых белков в небольших количествах содержатся фосфор, железо, марганец, магний, йод и др.
Содержание азота относительно постоянно во всех белках (около 16%), поэтому по содержанию белкового азота можно определять количество белка в биологических объектах.
