
- •I. Классификация органических реакций и реагентов
- •Классификация реакций по характеру разрыва связей в реагенте и субстрате
- •Нуклеофилы и электрофилы
- •Классификация реакций в соответствии с конечным результатом процесса. Символы органических реакций
- •Реакции присоединения (а-реакции)
- •В) Радикальное присоединение к ненасыщенным соединениям (ar-реакции)
- •Реакции отщепления (элиминирования), (символ е)
- •3. Реакционная способность органических соединений
- •Радикалы
- •Карбокатион
- •Третичный карбокатион.
- •Карбанионы
- •Три нитрогруппы за счёт электроноакцепторного влияния усиливают делокализацию отрицательного
- •4. Выводы
- •5. Основные термины
- •1. Гетеролиз (гетеролитическое расщепление связи)
- •3. Динамический электронный фактор
- •6. Эталонное решение задач
- •Эталонное решение задач второго типа
- •Решение
- •II. Кислотность и основность органических соединений
- •1. Протолитическая теория кислотно-основных превращений Бренстеда
- •1.1 Кислоты Бренстеда
- •1.2 Основания Бренстеда
- •Основание сопряженная сопряжённое Бренстеда кислота. Основание
- •Факторы, влияющие на силу оснований бренстеда
- •1) Факторы, влияющие на силу π-оснований Бренстеда
- •Б) Природа заместителей, связанных с основным центром.
- •2. Теория кислот и оснований Льюиса
- •Кислота Льюиса основание Льюиса солеобразный аддукт
- •3. Основные термины.
- •4. Эталонное решение задач эталонное решение задач первого типа
- •Решение
- •Эталонное решение задач второго типа
- •Решение
- •Эталонное решение задач третьего типа
- •Решение
- •Решение
Реакции присоединения (а-реакции)
Эти реакции характерны для ненасыщенных соединений. Реакционный центр субстрата должен иметь кратную связь (двойную или тройную). Здесь мы будем рассматривать те случаи, когда реакционный центр содержит двойную связь.
Электрофильное присоединение (АЕ-реакции)
Это реакции присоединения электрофильного реагента к двойной связи согласно следующей общей схеме:
![]()
субстрат-нуклеофил
Например, присоединение галогенов, галогеноводородов, воды и других соединений, содержащих подвижный водород, к алкенам.

субстрат- нуклеофил реагент АЕ- реакция
электрофил
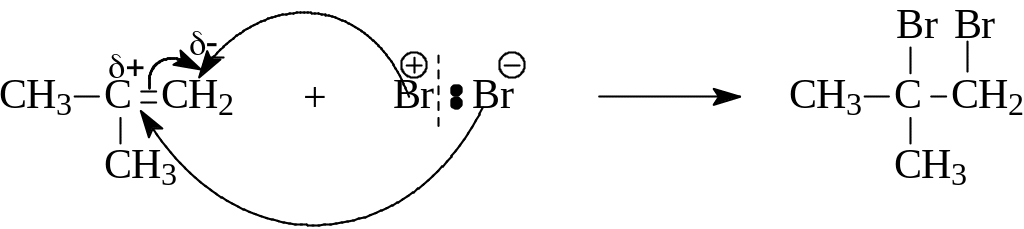
субстрат- нуклеофил реагент Br(+) – электрофил. (АЕ-реакция)
(π-избыточная система)
Реакцию начинает ион Br+ ,следовательно, это реакция электрофильного присоединения.
Нуклеофильное присоединение (AN-реакции)
Это реакции, начинающиеся с атаки реакционного центра субстрата нуклеофилом.
Например, реакция присоединения по кратной связи С=О протекает по следующей общей схеме:

субстрат реагент
электрофил нуклеофил
Рассмотрим реакцию присоединения синильной кислоты к альдегиду. Реакцию начинает нуклеофил CN-

реакционный реагент (АN -реакция.)
центр субстрата нуклеофил (CN -)
Приведенные схемы не отражают истинного механизма реакций.
Подробный механизм этих процессов будет рассмотрен детально в главе « Карбонильные соединения.»
В) Радикальное присоединение к ненасыщенным соединениям (ar-реакции)
Эти реакции встречаются редко. Протекают согласно следующей общей схеме:
![]()
Главным образом, это фотохимические процессы, например, присоединение хлора к бензолу на свету с образованием гексахлорциклогексана.

субстрат реагент гексахлорциклогесан
радикал CI. (АR—реакция.)
Все вышеизложенные реакции замещения и присоединения можно свести к следующим схемам:


Реакции отщепления (элиминирования), (символ е)
Реакции отщепления можно рассматривать как обратные реакциям присоединения. В результате этих процессов, как правило, образуются алкены. В качестве примеров можно привести взаимодействие галоидных алкилов со спиртовыми растворами щелочей, дегидратацию спиртов в кислой среде, отщепление аммиака от β-аминокислот.
![]()
2-хлорпропан пропен

бутанол-2 бутен-2

3-аминобутановая бутен-2-овая кислота
(кротоновая)
У реакций элиминирования нет подразделения на нуклеофильное, электрофильное и радикальное элиминирование. Эти реакции делят на две группы:
а) бимолекулярное элиминирование (символ Е2)
б) мономолекулярное элиминирование (символ Е1).
Молекулярность реакций определяется числом частиц, принимающих участие в элементарном акте процесса на самой медленной его стадии.
Если на самой медленной стадии данной реакции, определяющей кинетику всего процесса, в элементарном акте реакции участвует одна молекула - процесс мономолекулярный, например:
![]()
Если в элементарном акте участвуют две молекулы – процесс бимолекулярный, например:
CH3-CH2-CI + KCN → CH3-CH2-CN +KCI
Если участвуют три молекулы – процесс тримолекулярный. Истинно мономолекулярных реакций очень мало, тримолекулярные реакции тоже встречаются редко. Подавляющее большинство реакций - бимолекулярные.
Подробно механизм моно- и бимолекулярного замещения мы рассмотрим позже в главе, посвящённой свойствам галогенопроизводных и спиртов.
