
- •I. Классификация органических реакций и реагентов
- •Классификация реакций по характеру разрыва связей в реагенте и субстрате
- •Нуклеофилы и электрофилы
- •Классификация реакций в соответствии с конечным результатом процесса. Символы органических реакций
- •Реакции присоединения (а-реакции)
- •В) Радикальное присоединение к ненасыщенным соединениям (ar-реакции)
- •Реакции отщепления (элиминирования), (символ е)
- •3. Реакционная способность органических соединений
- •Радикалы
- •Карбокатион
- •Третичный карбокатион.
- •Карбанионы
- •Три нитрогруппы за счёт электроноакцепторного влияния усиливают делокализацию отрицательного
- •4. Выводы
- •5. Основные термины
- •1. Гетеролиз (гетеролитическое расщепление связи)
- •3. Динамический электронный фактор
- •6. Эталонное решение задач
- •Эталонное решение задач второго типа
- •Решение
- •II. Кислотность и основность органических соединений
- •1. Протолитическая теория кислотно-основных превращений Бренстеда
- •1.1 Кислоты Бренстеда
- •1.2 Основания Бренстеда
- •Основание сопряженная сопряжённое Бренстеда кислота. Основание
- •Факторы, влияющие на силу оснований бренстеда
- •1) Факторы, влияющие на силу π-оснований Бренстеда
- •Б) Природа заместителей, связанных с основным центром.
- •2. Теория кислот и оснований Льюиса
- •Кислота Льюиса основание Льюиса солеобразный аддукт
- •3. Основные термины.
- •4. Эталонное решение задач эталонное решение задач первого типа
- •Решение
- •Эталонное решение задач второго типа
- •Решение
- •Эталонное решение задач третьего типа
- •Решение
- •Решение
4. Эталонное решение задач эталонное решение задач первого типа
.
В каждом из следующих уравнений укажите среди реагентов кислоту и основание Бренстеда.
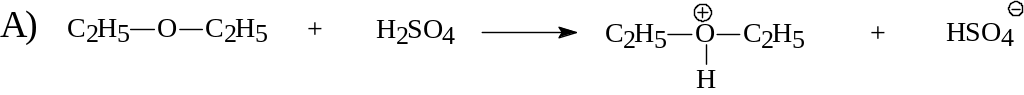
Б)
![]()
В)
![]()
Решение
А)
![]() основание Бренстеда. (имеет неподеленную
основание Бренстеда. (имеет неподеленную
пару электронов)
H2SO4 кислота Бренстеда.(отдает протон)
Б)
![]() основание
Бренстеда. (имеет неподеленную
основание
Бренстеда. (имеет неподеленную
пару электронов)
C2H5SH кислота Бренстеда. (отдает протон)
В) CH3-CH=CH2 основание Бренстеда.(имеет π-связь)
HBr кислота Бренстеда. (отдает протон)
Эталонное решение задач второго типа
В каждом из следующих уравнений укажите среди реагирующих веществ кислоту и основание Льюиса и распределите, представленные здесь кислоты, в порядке уменьшения их силы.
А)

Б)
![]()
В)

Решение
А) BCI3 - кислота Льюиса, (есть вакантная орбиталь у атома бора.)
![]() - основание Льюиса,
(на атоме кислорода
- основание Льюиса,
(на атоме кислорода
имеется неподеленная пара электронов.)
Б) AICI3 - кислота Льюиса, (есть вакантная орбиталь у атома алюминия)
CH3CI - основание Льюиса, (после гетеролитического разрыва связи в молекуле СН3CI, образуется отрицательно заряженный ион CI-.)
В)
![]() - кислота
Льюиса, (положительно заряженный ион
- кислота
Льюиса, (положительно заряженный ион
имеет свободную орбиталь)
![]() - основание
Льюиса, (кольцо содержит π-
связи)
- основание
Льюиса, (кольцо содержит π-
связи)
Самая сильная из приведенных выше кислот Льюиса- нитроний - катион NO2+ , более слабые кислоты – хлориды бора и алюминия. Самое сильное основание Льюиса - ион CI-, слабее – диметиловый эфир и самое слабое основание – бензол.
Эталонное решение задач третьего типа
А) В молекуле следующего соединения укажите кислотные центры и расположите их в порядке уменьшения силы:

Решение

СН-кислотный центр ОН-кислотные центры
Самый сильный ОН- кислотный центр в карбоксильной группе т.к. образующийся при диссоциации карбоксилат-ион устойчив за счет сопряжения отрицательного заряда с π- связью:

Более слабый ОН- кислотный центр в феноле: анион, образующийся в результате отщепления протона, стабилизирован сопряжением отрицательного заряда с π-системой кольца:
![]()
Атом водорода в ОН- кислотных центрах может замещаться на металл при действии щелочей.
Самый слабый – СН- кислотный центр. Атом водорода у sp-гибридизованного атома углерода может замещаться на металл при действии натрия в жидком аммиаке, но не замещается при действии щелочей.
Б) В молекуле следующего соединения расположите основные центры в порядке уменьшения их силы.

Решение
π-основание

аммониевый центр (2) оксониевый центр аммониевый центр (1).
Самый сильный аммониевый центр (1), слабее аммониевый центр(2), т.к. пара электронов азота сопряжена с кольцом; ещё слабее оксониевый центр: за счёт увеличения электроотрицательности атома кислорода основного центра присоединение протона затруднено. Самый слабый центр - сопряжённая π-система бензольного кольца.
ЭТАЛОННОЕ РЕШЕНИЕ ЗАДАЧ ЧЕТВЕРТОГО ТИПА
Какие из приведённых ниже соединений являются более сильными кислотами?
А)
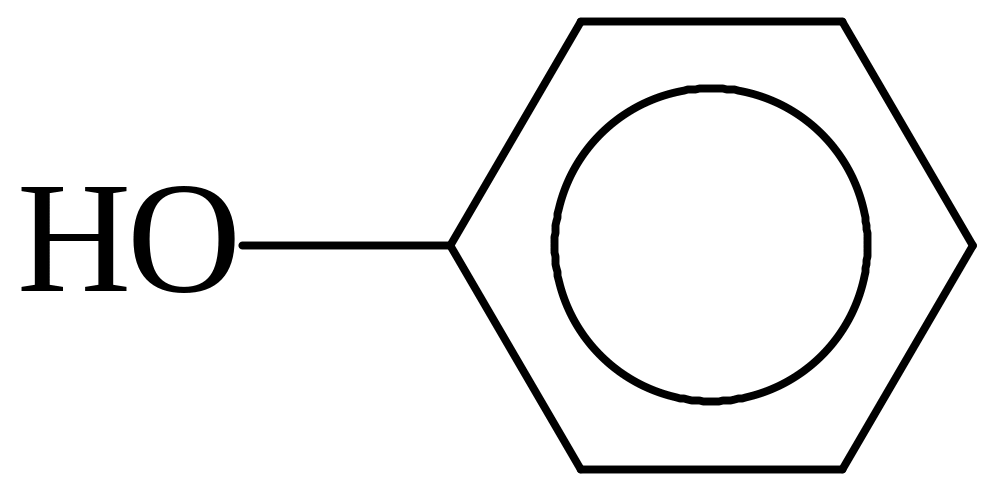 или
или
![]()
фенол п-гидроксибензолсульфокислота
Б)
![]() или
или
![]()
этантиол этанол
В)
C3H7OH или
пропанол фенол
