
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
5. Гідроліз солей
5.1. Визначення поняття
Реакції обмінної взаємодії між розчинником і розчиненою речовиною наз. сольволізом (для води – гідролізом).
У процесі взаємодії розчиненої солі з водою утворюються слабкі електроліти, що приводить до:
зміщення рівноваги дисоціаціїї води;
в кінцевому наслідку – це спричиняє зміну реакції (рН) середовища розчину.
Гідроліз - процес оборотний до реакції нейтралізації:
гідроліз
KNO2 + H2O HNO2 + KOH
нейтралізація
В реакціях гідролізу утворюються продукти протилежні за кислотно-основними властивостями.
Гідроліз складна хімічна рівновага, яка складається з трьох більш простих рівноваг:
KNO2 ⇆ NO2- + K+ - дисоціація розчиненої солі
+
H2O ↔ HOH ⇆ H+ + OH - - дисоціація води
↓↑
HNO2 – дисоціація слабкого електроліту,
що утворився
Отже, обов’язковою умовою протікання реакції гідролізу є утворення нового слабкого електроліту, якій зміщує рівновагу дисоціації води вправо.
5.2. Складання рівнянь гідролізу
При складанні рівнянь гідролізу дотримуються правил запису рівнянь йонних реакцій. Методика складання обмінних реакцій у розчинах електролітів наведена у розділах 3.3 і 3.4. Для рівнянь реакцій гідролізу солей дотримуються такої послідовності:
скласти молекулярне рівняння гідролізу;
скласти повне йонне рівняння гідролізу;
скласти скорочене йонне рівняння гідролізу;
визначити і записати реакцію середовища розчину (рН).
5.3. Основні випадки гідролізу
Склад продуктів гідролізу залежить від:
сили електролітів, що утворюються;
від величини заряду йонів, які гідролізуюються.
При гідролізі слабких однозарядних катіонів (Каt+) та аніонів (An-) процес протікає у один ступінь з утворенням кінцевих продуктів – слабких одноосновних кислот чи слабких однокислотних основ.
При гідролізі слабких багатозарядних катіонів (Katm+) та аніонів (Ann-) процес протікає у декілька ступенів з утворенням проміжних продуктів – кислих або основних солей.
Гідроліз солей за слабким катіоном (сіль слабкої основи і сильної кислоти) супроводжується утворенням слабкої основи і реакція середовища буде кислотною:
NH4+ + H2O ⇆ NH4OH + H+; pH < 7
слабка основа
Гідроліз солей за слабким аніоном (сіль сильної основи і слабкої кислоти) супроводжується утворенням слабкої кислоти і реакція середовища буде лужною:
СН3СОО- + H2O ⇆ СН3СООН + ОН -; рН 7
слабка кислота
Гідроліз солей за слабким катіоном та слабким аніоном приводить до одночасного утворення двох слабких електролітів – слабкої кислоти і слабкої основи і реакція середовища наближається до нейтральної:
CH3COO- + NH4+ + H2O ⇆ CH3COOH + NH4OH; pH ≈ 7
слабка кислота слабка основа
Солі утворені сильною кислотою і сильною основою на гідролізуються. Вода залишається єдиним слабким електролітом і реакція середовища буде нейтральною:
Н2О ⇆ Н+ + ОН -; рН = 7
Методика складання рівнянь основних випадків гідролізу наведена в табл. 5.
Приклад 5.3.1. Яка з наведених солей гідролізується: а) КВr; б) KCN?
Складіть відповідні рівняння і зазначте реакцію середовища розчину солі.
Розв’язок. Аналізуємо склад солей на можливість утворення слабких електролітів:
KBr KCN
KOH HBr KOH HCN
сильна основа сильна кислота сильна основа слабка кислота
Утворення слабкого електроліту відбудеться для речовини (б) – ціаніду калію.
Складаємо молекулярне рівняння гідролізу:
KCN + H2O ⇆ KOH + HCN
Складаємо повне йонне рівняння гідролізу:
K+ + CN- + H2O ⇆ HCN + K+ + OH -
Виключаємо катіони К+ в обох частинах рівняння. Записуємо скорочене йонне рівняння:
CN- + H2O ⇆ HCN + OH -
У надлишку ОН-, отже реакція середовища лужна, рН 7.
Таблиця 5. Методика складання рівнянь гідролізу солей
(основні випадки)
Приклад 5.3.2. Написати рівння гідролізу хлориду амонію і визначити
реакцію середовища (рН) розчину солі.
№ пп |
Операція |
Приклад |
1 |
Написати схему реакції подвійного обміну
|
NH4Cl + H2O ⇆ NH4OH + HCl
|
2 |
Визначити силу електролітів, що утворилися:
а) кислота
б) основа
|
HCl – одноосновна кислота, сильний електроліт
NH4OH – однокислотна основа, слабкий електроліт
|
3 |
Визначити типовий випадок гідролізу |
Відбувається гідроліз солі за слабким катіоном – NH4+, за аніоном сіль не гідролізується
|
4 |
Написати молекулярне рівняння гідролізу
|
NH4Cl + H2O ⇆ NH4OH + HCl
|
5 |
Написати повне йонно-молекулярне рівняння реакції |
При цьому керуються правилами запису, що застосовуються при прискладання йонних рівнянь:
NH4+ + + H2O ⇆ NH4OH + H++
|
6 |
Виключити (викреслити) однакові йони у лівій і правій частинах повного йонного рівняння |
N H4+ + + H2O ⇆ NH4OH + H++
|
7 |
Написати скорочене йонно-молекулярне рівняння рекції
|
NH4+ + H2O ⇆ NH4OH + H+
|
8 |
Зробити висновок про реакцію (рН) середовища розчину |
У правій частині скороченого іонно-молекулярного рівняння вільними залишаються йони H+, отже середовище кисле (рН < 7)
|
Примітка. У випадку гідролізу солі за катіоном і аніоном одночасно утворюються слабка кислота і слабка основа, наприклад:
CH3COONH4 + H2O ⇆ CH3COOH + NH4OH
CH3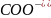 + NH4+ + H2O ⇆ CH3COOH
+ NH4OH
+ NH4+ + H2O ⇆ CH3COOH
+ NH4OH
Скласти скорочене іонно-молекулярне рівняння неможливо.
Визначення реакції середовища – слабкокисле, слабколужне, або нейтральне – вимагає порівняння констант дисоціації.
