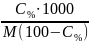- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
2. Концентрація розчиненої речовини
Розчини – це гомогенні (однофазні) системи, які складаються з двох або більшої кількості компонентів та продуктів їх взаємодії. Причому співвідношення компонентів можна змінювати (системи змінного складу). Властивості розчинів зумовлені вмістом розчиненої речовини в розчині або в розчиннику, тобто концентрацією розчинів.
Концентрація розчинів – це число, що відображує кількість або масу речовини, яка розчинена в одиниці маси чи об’єму розчину або розчинника.
Приблизні концентрації речовини:
розведений, концентрований;
насичений, ненасичений, перенасичений.
Кількісно насичений розчин характеризується коефіцієнтом розчинності, що показує яку масу речовини необхідно розчинити у певній масі розчинника (частіше 100 г), щоб при певній температурі отримати насичений розчин.
Приклад 2.1. При 18 0С у 100 г води необхідно розчинити 51,7 г нітрату плюмбуму (ІІ), щоб отримати насичений розчин. Отже, записуємо коефіцієнт розчинності
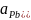 = 51,7 [г/100 г Н2О].
= 51,7 [г/100 г Н2О].
Усі типи концентрацій поділяють на масові та об’ємні.
Кількісний склад розчину виражають:
часткою розчиненої речовини (безрозмірні величини);
концентрацією розчиненої речовини (розмірні величини).
Масова частка – число одиниць маси розчиненої речовини, що містяться у 100 одиницях маси готового розчину.
ω =
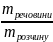 =
=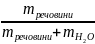 =
=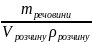 =
=
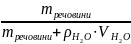
Процентна концентрація – (ω∙100)% - показує число грамів розчиненої речовини у 100 г готового розчину.
Приклад 2.2. Готовий 5% розчин сульфатної кислоти містить 5 г H2SO4 і 100 – 5 = 95 г води. Цьому відповідає також масова частка H2SO4: ω = 0,05.
Аналогічно визначаються:
молярна
частка χ(X)
=
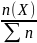 , n – кількість речовини,
моль;
, n – кількість речовини,
моль;
об’ємна
частка φ(X)
=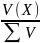 , V – об’єм.
, V – об’єм.
Молярна концентрація – відношення кількості речовини до об’єму готового розчину:
СМ
=
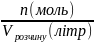 =
=
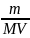 (моль/л; М)
(моль/л; М)
Молярність розчину показує число молів (молярних мас) речовини, що міститься в 1 л готового розчину.
Еквівалентна (нормальна) концентрація – відношення кількості речовини еквівалентів до об’єму готового розчину:
СН
=
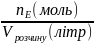 =
=
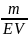 (моль/л; н.; N)
(моль/л; н.; N)
Нормальність розчину показує число моль еквівалентів (еквівалентних мас) речовини, що міститься в 1 л готового розчину.
Таблиця 1. Способи вираження складу (концентрації)
розчинів і співвідношення між ними
Назва, розрахункова формула і розмірність концентрацій |
Формули перерахунків концентрацій |
1. Молярна, СМ, моль/л
CM
= |
1)
CH
= CM
2)
C%
=
3)
Cмоляльн
= СМ
( |
2. Нормальна, Сн, моль екв./л
Сн
=
|
1)
CM
= CH(
2)
C%
=
3)
Cмоляльн
= Сн( |
3. Моляльна, Смоляльн, моль/кг
Смоляльн
=
|
1)
СМ
= Смоляльн(
2)
C%
=
3)
Сн
= Смоляльн( |
4. Масова частка, або процентна (ω, або C%)
C%
=
|
1)
СМ
=
2)
Сн
=
3)
Смоляльн=
|
Тут: m, m1, m2 – відповідно маси розчиненої речовини, розчинника і розчину; М, Е – відповідно маси моля і моля еквівалентів розчиненої речовини; V об’єм розчину, ρ – густина розчину; n, nE – відповідно числа моля і моля еквівалентів речовини.
Об’єми реагуючих розчинів оберенено пропорційні їх нормальностям:
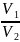
 =
=
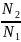 , або
N1V1
= N2V2
, або
N1V1
= N2V2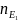 =
=
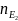
Приклад 2.3. На нейтралізацію 50 мл розчину сульфатної кислоти витрачено 25 мл 0,4 н. розчину NaOH. Визначити еквівалентну концентрацію сульфатної кислоти.
Розв’язок. У відповідності до закону еквіалентів записуємо:
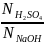 =
=
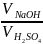 , отже,
, отже,
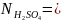
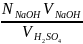 =
=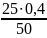 = 0,2 н.
= 0,2 н.
Розчин з точно відомою концентрацією розчиненої речовини наз.
титрованим. Титр розчину речовини – це відношення маси розчиненої речовини до об’єму розчину:
T
=
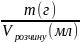 =
=
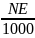 (г/см3).
(г/см3).
Приклад 2.4. Розрахуйте: а) процентну (С%); б) молярну (СМ);
в) нормальну (Сн); г) моляльну (См) концентрацію; д) титр розчину Н3РО4, які отримано при розчиненні 18 г кислоти у 282 см3 води.
Густина розчину 1,031 г/см3.
Розв’язок. а) процентна концентрація (масова частка) показує число грамів (одиниць маси) речовини, яка міститься у 100 г (одиниць маси) розчину. Густина води становить 1,000 г/см3. Тому масу води можна вважати рівною 282 г, відповідно маса отриманого розчину 18 + 282 = 300 г. Отже:
300 – 18
100 – С% С% =
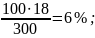
б) молярність показує кількість моль розчиненої речовини, яка міститься у 1 л розчину. Маса 1 л розчину 1031г. Масу кислоти у літрі розчину знаходимо із співвідношення
300 – 18
1031
– х х =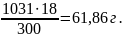
Молярність розчину отримаємо діленням числа грамів Н3РО4 на мольну масу Н3РО4 (97,99 г/моль)
СМ = 61,86/97,99 = 0,63 М;
в) нормальність показує число еквівалентів розчиненої речовини, яка міститься у 1 л розчину.
Еквівалентна маса Н3РО4 = М/3 =97,99/3 = 32,66 г/моль, отже
Сн = 61/32,66 = 1,89 н.;
г) моляльність показує число моль розчиненої речовини, яка міститься у 1000 г розчинника. Масу Н3РО4 знаходимо із співвідношення:
282 – 18
1000
– х х
=
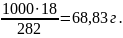
Отже См = 63,83/97,99 = 0,65 моль/кг.
д) титром розчину наз. кількість грамів розчиненої речовини у 1 см3 (мл) розчину. У 1 л розчину міститься 61,86 г кислоти, тому
Т = 61,86/1000 = 0,06186 г/см3.
Якщо відома нормальність розчину і еквівалентна маса (mЕ) розчиненої речовини, то титр легко розрахувати за формулою
Т = Сн∙mЕ/1000.
Приклад 2.5. До 1 л 10%-го розчину КОН (густина 1,092 г/см3) додали 0,5 л 5%-го розчину КОН ( густина 1,045 г/см3) і розбавили до об’єму 2 л. Розрахуйте молярну концентрацію отриманого розчину.
Розв’язок. Маса одного літра 10%-го розчину КОН 1092 г. У цьому розчині міститься
1092∙10/100 = 109,2 г КОН.
Маса 0,5 л 5%-го розчину 1045∙0,45 = 522,5 г. У такому розчині міститься 522,5∙5/100 = 26,125 г КОН.
У кінцевому об’ємі отриманого розчину (2 л) міститься 109, + 26,125 = 135,325 г КОН.
Отже, молярність такого розчину СМ = 135,325/2∙56,1 = 1.2 М,
тут: 56,10 г/ моль - молярна маса КОН.
Приклад 2.6. Який об’єм 96%-го розчину сульфатної кислоти з густиною 1,84 г/см3 необхідно взяти для приготування 3 л 0.4 н. розчину?
Розв’язок. Еквівалентна маса H2SO4 = М/2 = 98,08/2 = 49,04 г/моль.
Для приготування 3 л 0,4 н. розчину необхідно
49,04∙0,4∙3 = 58,848 г H2SO4. Маса 1 см3 96% кислоти 1,84 г.
У цьому розчині міститься 1,84∙96/100 = 1,768 г H2SO4.
Отже, для приготування 3 л 0,4 н. розчину необхідно взяти
58,848 : 1,766 = 33,32 см3 вихідної кислоти.
Між молярною та нормальною концентрацією розчинів існує пропорційний зв’язок, що дозволяє спростити розрахунки:
СМ
= fекв
∙ СН
і обернена величина СН
=
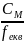
Приклад 2.7. Визначити а) нормальну концентрацію 1М розчину Н3РО4; б) молярну концентрацію 6 н. розчину сульфату феруму (ІІІ).
Розв’язок. а) Для фосфатної кислоти: fекв = 3. Отже :
СН = СМ : fекв = 1 : ⅓ = 3 н.
б) Записуємо фоpмулу речовини: Fe2(SO4)3. Визначаємо фактор еквівалентності fекв = 1/(2∙3) = 1/6. Отже:
СМ = СН ∙ fекв = 6 ∙ 1/6 = 1 М
Задачі та вправи
23. Розрахуйте молярну, еквівалентну і моляльну концентрації 16%-го розчину хлориду алюмінію з густиною 1,149 г/см3.
24. Який об’єм 0,3 н. розчину кислоти витратили на нейтралізацію розчину, який містить 0,32 г натрій гідроксиду у 40 см3 ?
25. До 300 г 20%-го розчину хлориду натрію додали 500 г 40%-го
розчину NaCl. Розрахуйте масову частку солі у отриманому розчині.
26. З 700 г 60%-го розчину сульфатної кислоти випаровуванням видалили 200 г води. Якою є масова концентрація залишкового розчину?
27. Розрахуйте об’єм 10%-го розчину карбонату натрію з густиною 1,105 г/см3, який необхідно взяти для приготування 5 л 2%-го розчину з густиною 1,02 г/см3.
28. Скільки грамів HNO3 містилося у розчині, якщо на його нейтралізацію витратили 35 см3 0,4 н. розчину NaOH ? Розрахуйте титр розчину NaOH.
29. З 10 кг 20%-го розчину при охолодженні виділилося 400 г солі. Якою є процентна концентрація охолодженого розчину?
Сполуки, що містять у кристалічному (твердому) стані зв’язану воду наз. кристалогідратами:
кристалогідрат
 Na2CO3∙10H2O
← кристалізаційна вода
Na2CO3∙10H2O
← кристалізаційна вода
Якщо для приготування розчину використовують не безводну речовину, а її кристалогідрат В∙nH2O, то враховують у розрахунках воду, що входить до складу кристалогідрату (кр).
Масу кристалогідрату визначають за формулою:
m кр
=
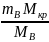 ,
,
тут: М кр – молярна маса кристалогідрату, mВ – розрахована маса речовини у певному розчині.
Визначення
маси води
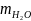 ,
яку необхідно додати до розрахованої
маси кристалогідрату з метою отримання
розчину визначеного складу з масою m
(p),
проводять за формулою:
,
яку необхідно додати до розрахованої
маси кристалогідрату з метою отримання
розчину визначеного складу з масою m
(p),
проводять за формулою:
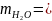 m (p)
- m кp.
m (p)
- m кp.
Приклад 2.8. Яку масу кристалогідрату CuSO4∙5H2О та об'єм води необхідно витратити для приготування 150 г 10% розчину сульфату купруму (ІІ) при кімнатній температурі?
Розв’язок.
mкр
=
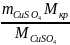 =
=
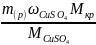 =
=
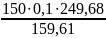 = 23,46 г;
= 23,46 г;
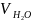 =
=
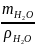 =
=
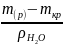 =
=
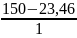 = 126,54 мл.
= 126,54 мл.
Отже, для приготування розчину необхідно взяти 23,46 г кристалогідрату CuSO4∙5H2О та 126,54 мл води.
Правило паралелограма використовується у випадку зливання двох розчинів з метою отримання нового розчину або розбавлення концентрованого розчину водою. Відношення маси першого розчину (m1) до маси другого розчину (m2) дорівнює відношенню різниці масових часток суміші (ω3) і другого розчину (ω2) до різниці масових часток першого розчину (ω1) і суміші (ω3):
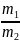 =
=
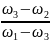
Практично зручною у використанні є діагональна схема (конверт Пірсона)
ω 1
(ω3
- ω2)
масові частки
1
(ω3
- ω2)
масові частки
ω3
ω 2 (ω1 - ω3) масові частки
Особливо необхідно звернути увагу на такі правила:
схемою можна користуватись коли відома густина розчинів, але тоді отримують відношення об’ємів вихідних розчинів;
при використанні води в діагональну схему проставляють масові частку 0%, або густину води 1 г/см3;
якщо додають тверду речовину, то в діагональну схему записують масову частку 100%;
кристалогідрат розглядають, як уявний розчин, з певною масовою часткою розчиненої речовини:

уявний розчин
CuSO4 ∙
5H2O
ω(CuSO4∙5H2O)
=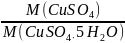 =
=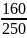 =
0,64 (64%)
=
0,64 (64%)
розчинена
речовина
Приклад 2.9. Яку масу 30% розчину гідроксиду калію необхідно додати до 200 г 90% розчину гідроксиду калію для отримання 50% розчину?
Розв’язок. Складаємо діагональну схему для визначення масових співвідношень:
30 90 – 50 = 40 масові частки
50
90 50 – 30 = 20 масові частки
Позначаємо масу 30% розчину КОН через x і розв’язуємо пропорцію x/200 = 40/20, отже, x =400 г 30% розчину КОН.
Задачі та вправи
30. Який об’єм хлоридної кислоти з масовою часткою хлориду гідрогену 0,25 (ρ 1,12 г/см3) потрібно добавити до 200 г хлоридної кислоти з масовою часткою хлориду гідрогену 0,05, щоб отримати розчин з масовою часткою хлориду гідрогену 0.2?
31. У якому об’ємному відношенні необхідно змішати розчини хлороводню з густинами 1,180 г/см3 та 1,048 г/см3, щоб приготувати розчин з густиною 1,068 г/см3?
32. Визначте об’єм води , який потрібно використати для розведення 200 г розчину сульфатної кислоти з масовою часткою речовини 40%, щоб отримати розчин з масовою часткою кислоти 20%.
33. Яку масу хлоридної кислоти (ω = 0,3) необхідно добавити до 400 г хлоридної кислоти з масовою часткою хлороводню 0,15, щоб отримати
розчин з масовою часткою речовини 0,2?
34. Визначте маси розчинів сульфатної кислоти з масовими частками 60% та 10%, які необхідно використати для приготування 600 мл розчину кислоти з ρ = 1,218 г/см3 і ω = 0,3.
35. Яку масу KCl необхідно додати до 450 г 8% - го розчину тієї ж солі, для отримання 12% - го розчину?

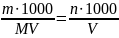 – число молів розчиненої речовини (n
= m/M) в 1 л
розчину
– число молів розчиненої речовини (n
= m/M) в 1 л
розчину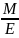 ;
;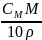 ;
; )
)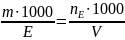 – число молів еквівалентів речовини
(nE
= m/E)
в 1 л розчину
– число молів еквівалентів речовини
(nE
= m/E)
в 1 л розчину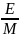 );
);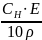 ;
;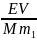 )
)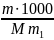 =
=
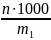 – число молів n речовини
в 1 кг розчинника
– число молів n речовини
в 1 кг розчинника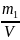 );
);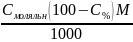 ;
;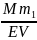 )
)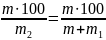 - маса розчиненої речовини в 100 г
готового розчину
- маса розчиненої речовини в 100 г
готового розчину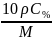 ;
;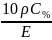 ;
;