
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
6. Окисно – відновні реакції
6.1. Теорія овр
ОВР – реакції, під час яких змінюються ступені окиснення елементів у сполуках, що реагують:
в структурі окисників – знижуються, коли окисники відновлюються;
в структурі відновників – підвищуються, коли відновники окиснюються.
Отже:

Окисник,
приєднуючи електрони (+ n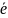 ),
відновлюється,
),
відновлюється,
ступінь окиснення при цьому знижується
*****
Відновник,
відщеплюючи електрони ( n
),
окиснюється,
n
),
окиснюється,
ступінь окиснення підвищується
В ОВР зазначені процеси здійснюються одночасно, причому число електронів, які відщеплює відновник, дорівнює числу електронів, які приєднує окисник.
Для окисника і відновника існують спряжені системи, які беруть участь в реакції:
 n
окиснена форма
відновлена форма
n
окиснена форма
відновлена форма
n
 ⇆
⇆

Fe+3 ⇆ Fe+2
6.2. Ступінь окиснення
Ступінь окиснення – це уявний заряд, який виникає на атомах у складі молекули, виходячи з припущення, що сполука складається з йонів.
Визначення ступенів окиснення основане на таких правилах:
ступені окиснення нейтральних атомів елементів, як і атомів у складі молекул простих речовин дорівнюють нулю.
Приклад 6.2.1. Нейтральні атоми хімічних елементів – Hg0, Ar0;
прості речовини: O20, O30, P40, S80
хімічні зв’язки, утворені за донорно-акцепторним механізмом ступенів окиснення атома не змінюють;
неполярні ковалентні зв’язки у молекулах складної речовини ступенів окиснення не змінюють.
При визначенні невідомих ступенів окиснення використовують ступені окиснення тих атомів елементів, у яких вони залишаються сталими.
Метали та металоїди: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1, Ag+1;
Be+2, Mg+2, Ca+2, Sr+2, Ba+2, Ra+2, Zn+2, Cd+2;
Al+3.
Неметали:
сeред неметалів тільки
флуор не має винятків -
 ;
;
оксиген
– найчастіше
 ;
за винятком пероксидів (
;
за винятком пероксидів ( і сполуки
і сполуки
OF2 (O+2).
Порівняння. Молекулярна формула:
+2 +1
H2O – оксид гідрогену (вода) і H2O2 – пероксид гідрогену
Структурна формула:
Н – О – Н Н – О – О – Н
гідроген
– найчастіше Н+1;
виняток - гідриди металів ( ).
).
Порівняння. Молекулярна формула:
-1 +1
NaH – гідрид натрію i HCl – хлорид гідрогену
Структурна формула:
Na – H Н – Cl
Розрахунок виконують алгебраїчним методом, спираючись на правило:
алгебраїчна сума усіх ступенів окиснення усіх атомів у складі молекули дорівнює нулю, а у складному іоні – його заряду.
Приклад 6.2.2. Визначити ступінь окиснення нітрогену у сполуках:
а) NH3; б) NH4OH.
Розв’язок. Позначаємо ступінь окиснення нітрогену як x. Будь-яка молекула є електронейтральною, тобто, підсумковий заряд дорівнює нулю.
а) Для розрахунку використовуємо наведені вище відомості про ступені окиснення.
Аміак (нітрид гідрогену)
x +1
( NH3)0
Складаємо алгебраїчне рівняння: 1∙ x + 3∙(+1) = 0. Отже x = - 3.
б) Особливістю є те, що у катіоні амонію додатковий ковалентний зв’язок утворений за донорно-акцепторним механізмом і ступеню окиснення нітрогену не змінює:
 H
координаційний зв’язок
H
координаційний зв’язок
H N →H OH
H
x +1 -2 +1
(NH4OH)0
Складаємо алгебраїчне рівняння: 1∙ x + 4∙(+1) + 1∙(-2) + 1∙(+1) = 0.
Отже x = - 3.
Приклад 6.2.3. Визначити ступінь окиснення: а) хрому у дихромат – іоні; б) фосфору у орто-фосфат – іоні.
Розв’язок. Будь-який іон – частинка, що має електричний заряд, який не дорівнює нулю.
а) Записуємо формулу аніона: Cr2O7 2-. Складаємо алгебраїчне рівняння
x -2
(Cr2O7)2- 2∙ x + 7∙(-2) = -2. Отже x = + 6.
б) Записуємо формулу аніона: РО43-. Складаємо алгебраїчне рівняння:
x -2
(РО4)3- 1∙ x + 4∙(-2) = -3. Отже x = + 5.
Задачі та вправи
62. Що називають окисненою формою та відновленою формою елемента? В чому відмінність значень ступенів окиснення і за рахунок яких процесів відбувається їх взаємне перетворення?
63. Що називають спряженою окисно-відновною парою? Скільки таких пар бере участь у ОВР? Зазначте спряжені пари у реакції
HClO + HCl = Cl2 + H2O.
64. Чому ступені окиснення атомів в молекулах простих речовин дорівнюють нулю, а в молекулах складних речовин їх числове значення більше чи менше нуля?
65. Визначити ступені окиснення:
а) фосфору в PH3, Ca(H2PO4)2, P2O3, Mg3P2; б) купруму в Cu2O, Cu(NO3)2, CuNO3, (CuOH)2CO3, CuCl2; в) сульфуру в K2SO3, Mg(HS)2, KAl(SO4)2, NaHSO4; г) нітрогену в NaNO2, KNO3, Ca3N2, N2O.
66. Визначте ступені окиснення всіх елементів, що входять до складу таких сполук: KHSO4, [Fe(OH)2]2CO3, [FeOH]2SO4, Mg(HCO3)2, Ca3(AsO4)2, Fe(NO3)3, KH2PO4, H3PO3.
