
- •Раздел 2
- •Глава 11
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием Расчёты, связанные с приготовлением растворов
- •Расчёты, связанные с титрованием
- •Глава 13
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •Метиловый красный
- •Тимолфталеин (бесцветный синий)
- •Феноловый красный
- •13.3. Кривые титрования
- •0,10 М раствором NaOh
- •Расчёты для построения кривой титрования
- •Расчёты для построения кривой титрования
- •0,10 М Na2co3 0,10 м раствором hCl
- •13.4. Факторы, влияющие на величину скачка титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.2. Критерии выбора растворителя для кислотно-основного титрования
- •14.3. Применение в фармацевтическом анализе Титрование в кислотных растворителях
- •Глава 15
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •1,010-3 М раствором эдта при рН 9,50 в присутствии 510-2 м nh3
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •Глава 16
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •Расчёты для построения кривой титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •Метод Мора
- •Метод Фольгарда
- •Особенность определения хлоридов
- •Особенность определения иодидов
- •Метод Фаянса
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •Титранты и стандартные вещества
- •Обнаружение конечной точки титрования
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
16.2.2. Способы обнаружения конечной точки титрования
Для обнаружения конечной точки титрования в аргентометрии могут быть использованы визуальные или инструментальные методы. Визуальные методы традиционно называют по их авторам.
Метод Мора
В данном методе в качестве индикатора для обнаружения конечной точки титрования используется хромат калия. Хромат калия в аргентометрии представляет собой осадительный индикатор.
Осадительными индикаторами называются вещества, выделяющиеся из раствора в виде осадка в хорошо заметной форме в точке эквивалентности или вблизи неё.

Величина
произведения растворимости у Ag2CrO4
(KS
= 1,110-12)
меньше, чем у AgCl,
но растворимость в воде больше (6,510-5
моль/л и 1,310-5
моль/л соответственно). При титровании
0,10 М NaCl
0,10 М раствором AgNO3
в точке эквивалентности pAg
= 4,87 (табл. 16.1). Следовательно, pCrO4
= pKs(Ag2CrO4)
– 2pAg
= 2,2,
![]() моль/л. Нижней (pAg
= 5,4) и верхней (pAg
= 4,3) границам скачка титрования
соответствуют концентрации CrO42-,
равные, соответственно, 110-1
и 410-4
моль/л. Практически
обнаружение конечной точки титрования
проводят при концентрациях дихромат-иона
0,005 – 0,01 моль/л. Для
того чтобы учесть количество титранта,
необходимое для образования минимального
визуально обнаруживаемого количества
Ag2CrO4,
проводят контрольный опыт. В качестве
модельного титруемого объекта при его
выполнении берут суспензию CaCO3.
моль/л. Нижней (pAg
= 5,4) и верхней (pAg
= 4,3) границам скачка титрования
соответствуют концентрации CrO42-,
равные, соответственно, 110-1
и 410-4
моль/л. Практически
обнаружение конечной точки титрования
проводят при концентрациях дихромат-иона
0,005 – 0,01 моль/л. Для
того чтобы учесть количество титранта,
необходимое для образования минимального
визуально обнаруживаемого количества
Ag2CrO4,
проводят контрольный опыт. В качестве
модельного титруемого объекта при его
выполнении берут суспензию CaCO3.
Метод Мора используется для определения хлорид- или бромид-ионов в нейтральных или слабощелочных растворах.

Метод Мора не используется для определения иодид- и тиоцианат ионов. Осадки AgI и AgSCN адсорбируют большое количество хромат- ионов, поэтому чёткое обнаружение конечной точки титрования становится невозможным. При использовании метода Мора в растворе не должны присутствовать катионы (например, Ba2+), образующие малорастворимые окрашенные хроматы.
Метод Фольгарда
В методе Фольгарда в качестве индикатора применяют железо-аммонийные квасцы.

Вторую часть аргентометрического титрования по методу Фольгарда иногда выделяют в самостоятельный титриметрический метод анализа – тиоцианатометрию. Данный метод используется для определения ионов Ag+.
Визуально появление красной окраски можно обнаружить, если концентрация FeSCN2+ ( = 1,0103) станет больше, чем 710-6 моль/л. При титровании 0,1 М AgNO3 0,1 М NH4SCN нижней границе скачка титрования будет соответствовать pSCN = 7,7, а верхней – 4,3 (pKs осадка AgSCN равен 11,97). Концентрации тиоцианат-ионов в нижней и верхней границах скачка титрования будут равны, соответственно, 210-8 и 510-5 моль/л. Появление окраски тиоцианатного комплекса будет происходить в пределах скачка титрования при концентрации ионов Fe3+:
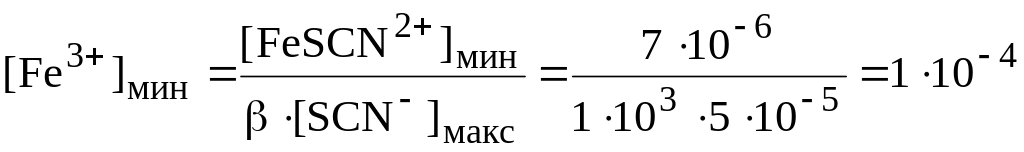 моль/л
моль/л
 моль/л
моль/л
Практически обнаружение конечной точки титрования проводят при концентрации Fe3+ 0,01 – 0,015 моль/л (1-2 мл насыщенного раствора железоаммонийных квасцов на 100 мл титруемого раствора).
Титрование по Фольгарду проводят в сильнокислой среде для того, чтобы препятствовать образованию окрашенных гидроксокомплексов Fe(III) из бесцветного аква-комплекса [Fe(H2O)6]3+. Для создания кислой среды используют HNO3 (или H2SO4). Концентрация HNO3 в титруемом растворе должна быть не менее 0,3 моль/л.
