
- •1. Кінетика гомогенних хімічних реакцій
- •Виконання роботи
- •2. Кінетика гетерогенних процесів
- •Виконання роботи
- •3. Поверхневий натяг
- •Виконання роботи
- •4. Седиментація
- •Виконання роботи
- •5. Електропровідність
- •Виконання роботи
- •6. Електрорушийні сили (ерс)
- •Виконання роботи
- •7. Потенціометричне визначення рН
- •Виконання роботи
- •8. Електроліз
- •Виконання роботи
2. Кінетика гетерогенних процесів
Гетерогенним називається процес, учасники якого перебувають у різних фазах. Такими процесами є розчинення, кристалізація, випаровування, розклад твердих сполук, хімічна взаємодія між речовинами, які перебувають в різних агрегатних станах.
Гетерогенні процеси складаються з декількох послідовних стадій. Швидкість всього процесу визначається швидкістю найповільнішої (лімітуючої) стадії. Такою стадією зазвичай є або підвід реагентів до поверхні розділу фаз, або відведення продуктів від цієї поверхні внаслідок дифузії.
Дифузія – це процес самочинного вирівнювання концентрацій. За першим законом Фіка:
|
(2.1) |
де dn
– кількість молів перенесеної дифузією
речовини через переріз S
за час d
при градієнті концентрації
![]() ;
D
- коефіцієнт дифузії, який чисельно
дорівнює кількості речовини, що дифундує
за одиницю часу через одиницю перерізу
при градієнті концентрації, рівному
одиниці. Коефіцієнт дифузії має
розмірність
;
D
- коефіцієнт дифузії, який чисельно
дорівнює кількості речовини, що дифундує
за одиницю часу через одиницю перерізу
при градієнті концентрації, рівному
одиниці. Коефіцієнт дифузії має
розмірність
![]() .
У напрямку дифузії
0,
тому в рівнянні (2.1) стоїть знак мінус.
.
У напрямку дифузії
0,
тому в рівнянні (2.1) стоїть знак мінус.
Розглянемо процес розчинення твердої речовини у розчині з концентрацією с. Його швидкість можна виразити збільшенням концентрації розчиненої речовини за одиницю часу:
|
(2.2) |
де V – об’єм розчину.
Якщо процес лімітується дифузією, то безпосередньо біля поверхні твердої речовини розчин буде практично насиченим (рис. 2).
Дифузія відбуватиметься в нерухомому, так званому дифузійному шарі, який розташований поблизу поверхні. Якщо товщина дифузійного шару становить δ, то градієнт концентрації дорівнює:
|
(2.3) |
і згідно з (2.1):
-
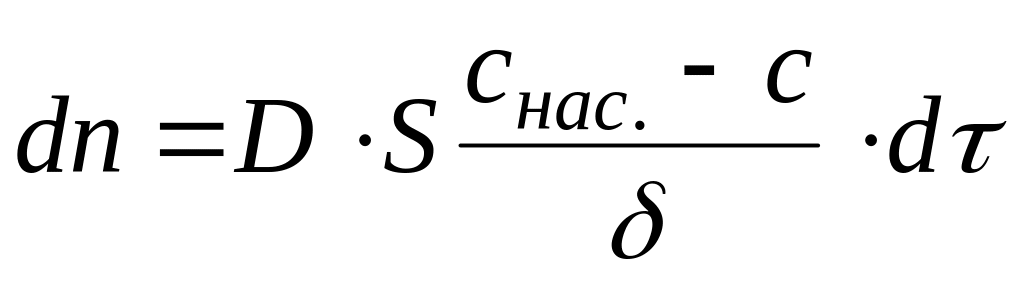 .
.(2.4)
Тоді швидкість процесу розчинення буде виражатися рівнянням:
![]()

![]() (2.5)
(2.5)
де
![]() - константа швидкості процесу розчинення
твердої речовини. З рівняння (2.5) випливає,
що процес розчинення в умовах стаціонарної
дифузії має перший порядок.
- константа швидкості процесу розчинення
твердої речовини. З рівняння (2.5) випливає,
що процес розчинення в умовах стаціонарної
дифузії має перший порядок.
Якщо
рівняння (2.5) проінтегрувати, розділивши
змінні, то отримуємо формулу для
розрахунку константи швидкості процесу
розчинення:
|
(2.6) |
Виконання роботи
Мета роботи: дослідити кінетику гетерогенного процесу розчинення твердої бензойної кислоти у воді та визначити його порядок.
На столик магнітної мішалки ставлять стакан ємністю 500 мл, наливають в нього мірним циліндром 400 мл дистильованої води і кладуть якір магнітної мішалки. Включають мішалку і встановлюють таку швидкість обертання якоря, при якій вода добре перемішується.
Скляну паличку з наплавленим циліндром бензойної кислоти закріплюють у штативі над поверхнею води по центру стакану. Далі одночасно з включенням секундоміра занурюють циліндр у воду. Через 5, 10, 15, 20, 25 хвилин від початку досліду (не припиняючи перемішування) обережно відбирають зі стакану піпеткою 10 мл розчину і титрують його 0,01 н розчином лугу з індикатором фенолфталеїном до появи рожевого забарвлення. Дані експерименту зводять у таблицю 2.1.
Для
розрахунків необхідно знати концентрацію
насиченого розчину кислоти або Vmax
- об’єм лугу (мл), який витрачається на
титрування насиченого розчину. Для
цього відбирають 10 мл насиченого розчину
бензойної кислоти і титрують розчином
лугу за наявності індикатора. Титрування
проводять двічі або тричі. Записують
результати титрування насиченого
розчину: ![]() =
мл
=
мл
![]() = мл
= мл
_________________
середнє Vmax = мл
Константу швидкості розраховують за формулою:
![]() ,
,
де V – об’єм лугу (мл) , який пішов на титрування проби в певний проміжок часу.
Експериментальні та розраховані дані заносять у таблицю 2.1.
Таблиця 2.1 – Залежність об’єму лугу, витраченого на титрування розчину бензойної кислоти, від часу; константи швидкості процесу.
Час з початку досліду , хв |
Об’єм лугу V, мл |
|
k, хв -1 |
5 |
|
|
|
10 |
|
|
|
15 |
|
|
|
20 |
|
|
|
25 |
|
|
|
|
kсер.= |
||
Будують
графік залежності
![]() .
За даними таблиці 2.1 роблять висновок
щодо порядку досліджуваного процесу,
записують його кінетичне рівняння.
.
За даними таблиці 2.1 роблять висновок
щодо порядку досліджуваного процесу,
записують його кінетичне рівняння.
ЛІТЕРАТУРА: 1, с. 467 - 474; 3, с. 341 – 343; 6, с. 97 -100.
