
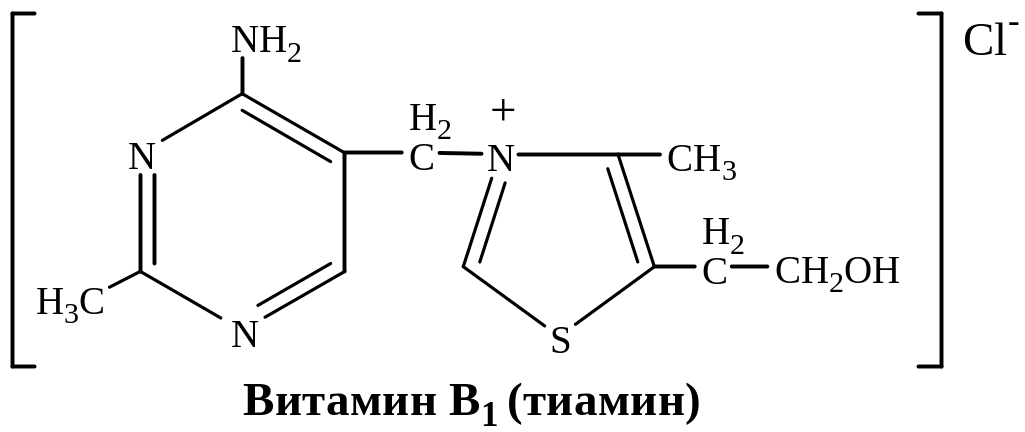
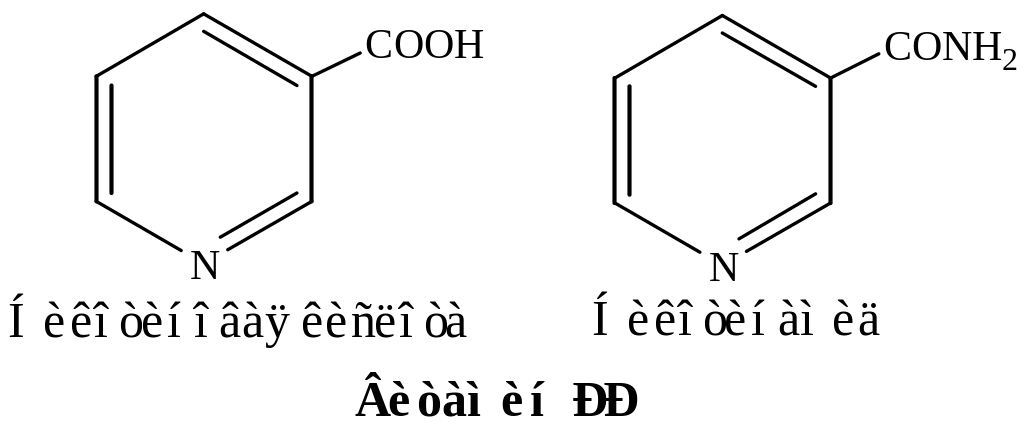
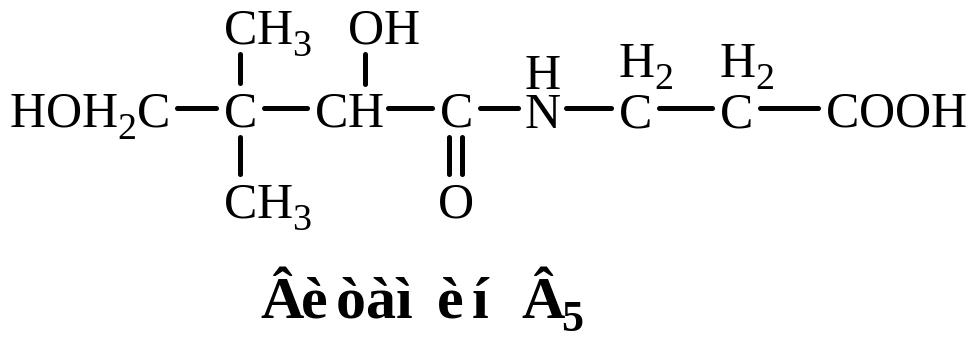
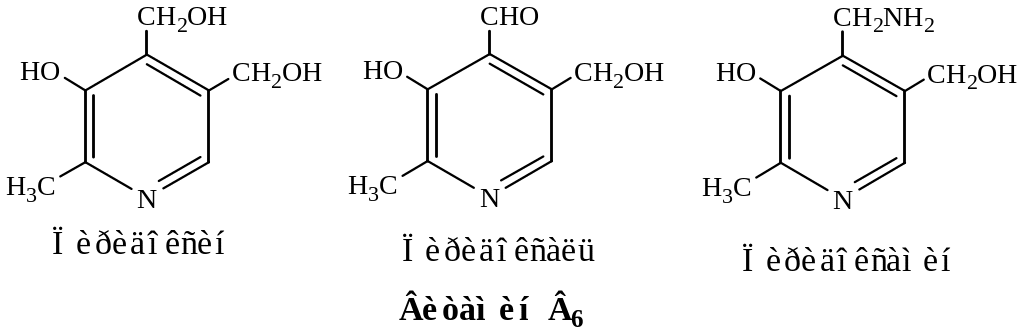
- •15. Формулы витаминов-коферментов
- •Амилаза слюны обладает максимальной активностью в слабощелочной среде, ее активируют ионы кальция и хлорида
- •Работа № 1. Получение раствора амилазы слюны.
- •Работа № 2. Обнаружение специфичности фермента амилазы.
- •Работа № 4. Ингибирование ферментов солями тяжелых металлов.
- •Раздел 3.
- •1. При растворении в воде белка, содержащего аминокислоты лизин, аспартат и гистидин, молекула белка приобретает отрицательный заряд. Что можно сказать о его аминокислотном составе?
- •2. При растворении в воде молекулы белка приобретают положительный заряд.
- •При растворении в воде белка, содержащего аминокислоты глутамат, аргинин, валин, молекулы белка приобрели положительный заряд. Что можно сказать о аминокислотном составе белка ?
- •59. Для электрофореза и обработки каналов врач- стоматолог применил фермент
ГОУ ВПО УГМА ПОСЗДРАВА
Кафедра биохимии
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ
Факультет стоматологический
Курс1 семестр 2
ТЕМА: МЕДИЦИНСКАЯ ЭНЗИМОЛОГИЯ
15. Формулы витаминов-коферментов


Информация о ферменте слюны- амилазе.
α-Амилаза (КФ 3.2.1.1)
Выделяется слюнными железами и содержится в смешанной слюне (ротовой жидкости). Количество амилазы составляет до 10% от всего белка слюны. Большая часть амилазы- 70% вырабатывается околоушной железой, остальное количество- подчелюстной. Амилазу относят к маркерным ферментам, дающим информацию о состоянии слюнных желез.
Амилазы (amilum - лат – крахмал) – ферменты класса гидролаз, катализируют гидролиз всех видов растительных крахмалов , гликогена( в клетках костной ткани), существует в виде нескольких изоферментов, изоэлектрическая точка в слабокислой среде. В организме человека слюнными железами и панкреатической железой выделяется
α-Аамилаза Присутствует у многих одноклеточных и грибов, использующих глюкозу для жизнедеятельности. (например, « сбраживающие» дрожжи).
α-Амилаза (молекулярная масс до 50 тыс) - принадлежит классу гидролаз, способна гидролизовать α(1-4)-гликозидные связи между молекулами глюкозы в полисахариде, содержащем подряд три и более остатков глюкозы, является эндогликозидазой. В цепи крахмала или пищевого гликогена гидролизует полисахаридную цепь путем атак в случайных точках, расположенных далеко от начала полисахаридной цепи. В результате гидролиза образуются короткие полисахаридные цепи- декстины, в небольшом количестве мальтоза..
α-Амилаза имеет пять подцентров, каждый из которых способен удерживать остаток глюкозы. Гидролиз происходит в тот момент, когда фермент превращает пирановый цикл α- глюкозы из конформации кресла в полукресло, вращая вокруг связи С-2 - С-3 в цикле. Молекула амилозы скользит по поверхности фермента, перемещаясь после акта гидролиза. Мальтобионовая кислота является мощным ингибитором активности α-амилазы.
Амилаза слюны обладает максимальной активностью в слабощелочной среде, ее активируют ионы кальция и хлорида
ß-Амилаза ( молекулярная масса 50 -200 тыс) последовательно отщепляет остатки мальтозы от невосстанавливающего конца полисахаридной цепи. Содержится в солоде
γ-Амилаза- экзо 1,4- α-гликозидаза, молекулярная масса 50 – 100 тыс.) постепенно отщепляет остатки глюкозы от невосстанавливающего конца полисахаридной цепи и образует ß- глюкозу. Содержится в плесневых грибах.
Амилаза слюны и поджелудочной железы являются изоферментами, они отличаются по физико-химическим характеристикам и имеют различную электрофоретическую подвижность. В случае воспалительных процессов в поджелудочной железе панкреатическая амилаза выделяется в кровь и фильтруется в состав мочи. Амилазная активность крови и мочи исследуется для оценки тяжести воспалительного процесса в поджелудочной железе (определение диастазной активности крови или мочи) .
Амилаза используется в промышленности для «осахаривания» крахмала в производстве пищевого и медицинского этилового спирта.
Лабораторные работы
