
- •Гідроксивуглеводні
- •7.1 Класифікація гідроксивуглеводнів:
- •Будова та реакційна здатність
- •Хімічні властивості
- •Реакції нуклеофільного заміщення гідроксильної групи sn
- •2. Реакція естерифікації.
- •3. Заміщення гідроксилу на аміногрупу:
- •3Дегідратація спиртів При нагріванні спиртів в присутності концентрованої сірчаної кислоти або безводної фосфорної відбувається вилучення води від спиртів, тобто їх дегідратація.
- •7.3.3 Методи добування спиртів
- •Методи добування фенолів
3. Заміщення гідроксилу на аміногрупу:
Порівняно з галогеналканами спирти важче реагують за умов реакції нуклеофільного заміщення (в жорстких умовах або в присутності каталізаторів):
![]()
![]()
![]()
П ри
нагріванні фенолів з амоніаком і хлоридом
алюмінію до 400оС
утворюються аміни:
ри
нагріванні фенолів з амоніаком і хлоридом
алюмінію до 400оС
утворюються аміни:
п-крезол п-толуїдин
З начно
легше відбувається обмін гідроксильної
групи в нафтолах – реакція Бухерера:
начно
легше відбувається обмін гідроксильної
групи в нафтолах – реакція Бухерера:
3Дегідратація спиртів При нагріванні спиртів в присутності концентрованої сірчаної кислоти або безводної фосфорної відбувається вилучення води від спиртів, тобто їх дегідратація.
Д егідратація
спиртів може бути внутрішньомолекулярною
та міжмолекулярною. Напря мок
дегідратації залежить від природи
спирту та умов проведення реакції. При
внутрішньомолекулярній дегідратації
одноатомного спирту утворюється алкен,
а при міжмолекулярній – етер. Це два
конкуруючих процеси, напрямок яких
можна регулювати відповідними умовами:
егідратація
спиртів може бути внутрішньомолекулярною
та міжмолекулярною. Напря мок
дегідратації залежить від природи
спирту та умов проведення реакції. При
внутрішньомолекулярній дегідратації
одноатомного спирту утворюється алкен,
а при міжмолекулярній – етер. Це два
конкуруючих процеси, напрямок яких
можна регулювати відповідними умовами:
етилен Е SN діетиловий етер
Кислота потрібна для протонування спирту, який далі повільно дисоціює спочатку з утворенням карбонієвого іону, а потім алкену (механізм Е1):

 У 1975 р. О.М. Зайцев
з’ясував, що при відщеплюванні води
від спиртів утворюються найбільш
алкільовані заміщені етиленові вуглеводні
- правило
Зайцева.
У 1975 р. О.М. Зайцев
з’ясував, що при відщеплюванні води
від спиртів утворюються найбільш
алкільовані заміщені етиленові вуглеводні
- правило
Зайцева.
С пирти
легко дегідратуються й у газовій фазі
над нагрітим оксидом алюмінію або
поруватою глиною:
пирти
легко дегідратуються й у газовій фазі
над нагрітим оксидом алюмінію або
поруватою глиною:
П ри
пропусканні пари спирту над оксидом
алюмінію при температурі 200-250оС
утворюються етери, а при температурах
300-400оС
відбувається внутрішньомолекулярна
дегідратація з утворенням алкенів.
ри
пропусканні пари спирту над оксидом
алюмінію при температурі 200-250оС
утворюються етери, а при температурах
300-400оС
відбувається внутрішньомолекулярна
дегідратація з утворенням алкенів.
циклогексанол циклогексен
Вторинні спирти дегідратуються при нагріванні з 85% фосфорною кислотою при 160-170оС або 60-70% сірчаною кислотою при 90-100оС за правилом Зайцева:

Деякі третинні спирти дегідратуються навіть при перегонці.
А лкандіоли
при внутрішньомолекулярній дегідратації
утворюють ряд сполук, наприклад:
лкандіоли
при внутрішньомолекулярній дегідратації
утворюють ряд сполук, наприклад:
вініловий спирт ацетальдегід

пропандіол-1,3 аліловий спирт

бутандіол-1,4 тетрагідрофуран
Міжмолекулярною дегідратацією діоли утворюють лінійні та циклічні етери. Наприклад, переганяючи етиленгліколь із сірчаною кислотою можна отримати діоксан:

діоксан
або діетиленгліколь:
![]()
етиленгліколь діетиленгліколь
Молекули етиленгліколю можуть вступати між собою в реакцію поліконденсації з утворенням поліетеру – поліетиленгліколю:

Феноли утворюють етери за умов реакції Вільямсона:
Реакція Вільямсона (утворення етерів)

фенетол
Через те, що алкілюється кисневий атом, цей тип реакцій має назву О-алкілювання.
![]()
феноксиоцтова кислота
Метилові етери отримують взаємодією фенолятів з диметилсульфатом:
![]()
диметилсульфат анізол
Г ліцерин
при нагріванні з сірчаною кислотою або
гідросульфітом натрію утворює акролеїн:
ліцерин
при нагріванні з сірчаною кислотою або
гідросульфітом натрію утворює акролеїн:
Окиснення спиртів
Одноатомні спирти окиснюються при кімнатній температурі такими окисниками, як KMnO4 тa хромова суміш, а при 300-500оС у присутності мідних та інших каталізаторів вони окиснюються киснем повітря.
Первинні спирти окиснюються до альдегідів, які можуть окиснюватися до карбонових кислот:

Щоб перетворити спирт на альдегід краще скористатися методом каталітичного дегідрування: При пропусканні пари спирту над подрібненою міддю або мідною сіткою при 280-300о С відбувається вилучення молекули водню від молекули спирту:

В торинні
спирти при окисненні чи дегідруванні
перетворюються на кетони.
торинні
спирти при окисненні чи дегідруванні
перетворюються на кетони.

ізопропіловий спирт ацетон

циклогексанол адипінова кислота
Третинні спирти окиснюются важко з одночасним розривом вуглецевого ланцюга й утворенням суміші карбонових кислот і кетонів.
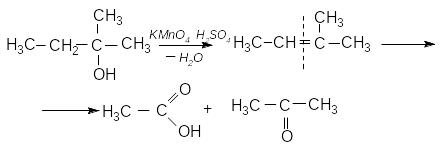
Отже, за продуктами окиснення спиртів можна зробити висновок про їх будову.
Гліколі окиснюються послідовно:

щавлева к-та гліоксаль етиленгліколь гліколевий альдегід гліколева к-та
Продуктами цієї реакції можуть бути оксіальдегіди, оксикислоти, оксокислоти та дикарбонові кислоти. Ці продукти окиснення широко використовуються в тонкому органічному синтезі.
При окисненні 1,2-гліколів йодною кислотою окиснення відбувається з розривом вуглець-вуглецевого звязку:

При окисненні гліцерину різними окисниками можна отримати різноманітні речовини:
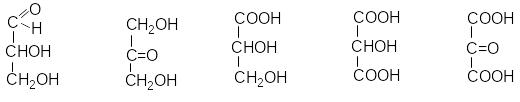
гліцериновий діоксиацетон гліцеринова тартронова мезоксалева
альдегід кислота кислота кислота
 6. Окиснення
фенолів -
залежно від природи окисника та умов
проведення реакції можна отримати різні
продукти.
6. Окиснення
фенолів -
залежно від природи окисника та умов
проведення реакції можна отримати різні
продукти.
гідрохінон бензохінон-1,4


пірокатехін бензохінон-1,2

Я кісна
реакція на фенольний (енольний) гідроксил
з хлоридом заліза (ІІІ)
кісна
реакція на фенольний (енольний) гідроксил
з хлоридом заліза (ІІІ)
Водний розчин забарвлюється на фіолетово-червоний колір унаслідок утворення комплексного феноляту заліза.
Реакції електрофільного заміщення (SE) Наявність електронодонорної гідроксильної групи (+ М-ефект) сильно збільшує реакційну здатність бензенового ядра до реакцій електрофільного заміщення.
Нітрування. При нітруванні розведеною азотною кислотою фенол при кімнатній температурі перетворюється на орто- й пара-нітрофеноли:

Концентрована азотна кислота перетворює фенол на пікринову кислоту (2,4,6-тринітрофенол):

С
 ульфування.
Сульфування фенолу відбувається легко
з утворенням орто-
й пара-гідроксибензенсульфонових
кислот:
ульфування.
Сульфування фенолу відбувається легко
з утворенням орто-
й пара-гідроксибензенсульфонових
кислот:
Г
 алогенування.
Завдяки високій реакційній здатності
фенолів навіть при взаємодії з бромною
водою утворюється осад 2,4,6-трибромфенолу
(якісна реакція):
алогенування.
Завдяки високій реакційній здатності
фенолів навіть при взаємодії з бромною
водою утворюється осад 2,4,6-трибромфенолу
(якісна реакція):
П роте
за відповідних умов (наприклад, у
неполярному розчиннику) можуть
утворюватися орто-
і пара-галогенофеноли:
роте
за відповідних умов (наприклад, у
неполярному розчиннику) можуть
утворюватися орто-
і пара-галогенофеноли:
При хлоруванні переважно утворюється орто-ізомер
Алкілювання та ацилювання за Фріделем-Крафтсом. Алкілювання фенолів за умов реакції Фріделя-Крафтса відбувається з невеликими виходами. Наприклад, при взаємодії фенолу з алілбромідом у присутності АlCl3 утворюється алілфенол:

о-алілфенол
При взаємодії з трет-бутилхлоридом утворюється п-трет-бутилфенол:

Ацетилювання фенолів відбувається за цих же умов, проте частіше ацетильні похідні отримують перегрупуванням Фріса:

5. Інші реакції електрофільного заміщення. Завдяки високій реакційній здатності бензенового ядра фенолів, що зумовлена впливом гідроксильної групи, фенолам властиві й такі реакції електрофільного заміщення як:
а )
Нітрозування
)
Нітрозування
б )
Азосполучення
)
Азосполучення
в )
Реакція
Кольбе. При
нагріванні феноляту натрію в току СО2
утворюється саліцилат натрію
)
Реакція
Кольбе. При
нагріванні феноляту натрію в току СО2
утворюється саліцилат натрію
саліцилат натрію
г) Реакція Раймера-Тімана. Синтез ароматичних альдегідів. При обробці фенолу хлороформом з водним лугом можна ввести в бензенове ядро альдегідну групу в орто-положення.

Д) Гідроксиметилювання. При обробці фенолів формальдегідом в кислому або лужному середовищі спочатку утворюється суміш о- і п-гідроксиметилфенолів, які далі реагують з фенолом з утворенням фенолоформальдегідних смол. Н2С=О + Н+ С+Н2ОН

А бо:
бо:
2,2-бис-(4-гідроксифеніл)пропан

Відновлення. Фенол можна перетворити на циклогексанол каталітичним відновленням:
Двох або трьохатомні феноли краще розчиняються у воді, дуже легко окиснюються , навіть легше, ніж фенол вступають в реакції електрофільного заміщення, утворюють комплекси х металами.
Двох- або трьохатомні феноли, в яких гідроксильні групи розташовані в мета-положенні відносно одна одної, здатні до кето-енольної таутомерії і легко втрачають ароматичність.

Флороглюцину також властива кето-енольна таутомерія й він взаємодіє з діазометаном в енольній формі, а з гідроксиламіном – в кетонній формі:
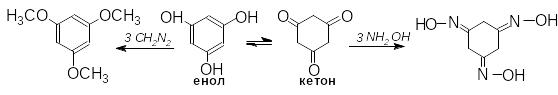
1,3,5-триметоксибензен триоксим флороглюцину
