
- •1. Класифікація, будова, ізомерія
- •2. Хімічні властивості
- •Механізм:
- •1. Галогенування
- •2. Нітрування за Коноваловим
- •Ненасичені вуглеводні:
- •Реакції ae:
- •Реакції аr:
- •Реакції аn:
- •Реакції окиснення
- •Ізомеризація алканів.
- •5.1.4 Методи добування алканів
- •Методи добування циклоалканів
- •Методи добування алкенів
- •1. Дегідрування й крекінг алканів (промисловий метод)
- •2. Вилучення води від спиртів (дегідратація).
- •3. Вилучення галогеноводню або галогену від галогеналканів (дегідрогалогенування)
- •4. Гідрування дієнів і алкінів.
- •5.5.2 Методи добування алкінів
- •Можливий вплив аліфатичних вуглеводнів на довкілля:
2. Нітрування за Коноваловим
При звичайній температурі алкани не взаємодіють з концентрованою азотною кислотою, а при нагріванні азотна кислота діє як окисник. Але якщо подіяти на алкани розведеною азотною кислотою (10-20%) при нагріванні до 140оС в автоклаві, то атоми водню заміщуються на нітрогрупу, тобто відбувається реакція нітрування. Реакція названа за ім’ям М.І.Коновалова, який уперше здійснив її в 1888 г. Більш сучасним є метод парофазного нітрування – в газовій фазі при температурі 400-500оС. Швидкість реакції нітрування алканів досить повільна і вихід її низький. Реакція нітрування супроводжується оксидаційними процесами, тому, разом з нітроалканами, ймовірне утворення спиртів, альдегідів, кетонів і кислот. Тобто при парофазному нітруванні (пропускання парі азотної кислоти та алкану при 420-450 С) можливий також розрив СС зв’язку, тобто відбувається крекінг, який веде до утворення нітроалканів з меншою кількістю вуглецевих атомів. Наприклад, при нітруванні пропану з загальним виходом 21% утворюється суміш продуктів такого складу:
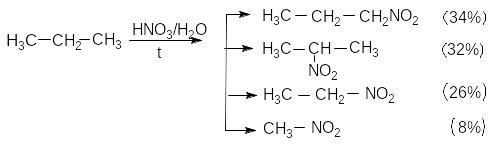
З етану утворюється суміш, що містить 90% нітроетану та 10% нітрометану
Реакція нітрування алканів - радикальний процес (SR).
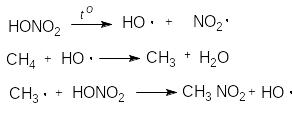
Як нітруючий агент використовують також оксид азоту (IV).
3. Сульфоокиснення и сульфохлорування також відносять до реакцій радикального заміщення алканів. Сама сірчана кислота ні за яких умов не заміщує водневі атоми. Але діоксид сірки за умов фотохімічної реакції здатен заміщувати водневі атоми в алканах та циклоалканах.
а) Сульфоокиснення
![]() алкансульфонова
к-та
алкансульфонова
к-та
б) Сульфохлорування алканів. При взаємодії алкану з хлором та сірчаним ангідридом відбувається заміщення водню на хлорсульфонільну групу.
![]()
алкансульфохлорид
Реакція сульфохлорування має широке практичне застосування. Алкансульфохлориди, що взаємодіють з лугами або содою, легко утворюють солі сульфокислот, велику кількість з яких (С12 - С18) використовують для виготовлення синтетичних миючих засобів (СМЗ), тому що вони виявляють властивості поверхнево-активних речовин і здатні емульговати у воді жири та олії. Синтетичні детергенти у великій кількості добувають в промисловості сульфохлоруванням гасової фракції нафти.
Циклоалкани: Хімічні властивості циклоалканів значною мірою залежать від розміру циклу
П![]() ри
фотохімічному бромуванні або хлоруванні
циклопропанових вуглеводнів відбувається
розкриття тричленного:
ри
фотохімічному бромуванні або хлоруванні
циклопропанових вуглеводнів відбувається
розкриття тричленного:
 Циклопропани
приєднують бром і йод з утворенням,
відповідно, 1,3-дибром- і 1,3-дійодпропанів:
Циклопропани
приєднують бром і йод з утворенням,
відповідно, 1,3-дибром- і 1,3-дійодпропанів:
+ Hal2 HalCH2 CH2 CH2Hal або
 Вищі
циклоалкани, подібно алканам, вступають
з бромом до реакцій заміщення:
Вищі
циклоалкани, подібно алканам, вступають
з бромом до реакцій заміщення:
З хлором вищі циклоалкани утворюють продукти радикального заміщення атома водню на атом хлору:
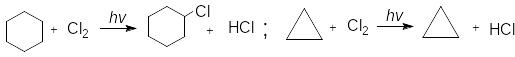
Проте, при фотохімічному хлоруванні циклопропану утворюється також хлорциклопропан. Реакції розкриття циклу властиві тільки для напряжених циклоалканів, а хімічні властивості стійких циклоалканів нічим не відрізняються від хімічних властивостей алканів.
Тільки циклопропан і його похідні здатні приєднувати бромоводень, причому приєднання відбувається згідно з правилом Марковнікова:
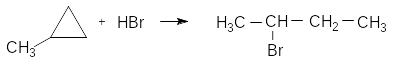
2-бромбутан
Циклобутан з галогеноводнями на реагує!
Гідрування (дегідрування).
![]() Циклопропан
легко реагує з воднем над нікелевим
каталізатором при температурах нижчих
100оС
з утворенням пропану:
Циклопропан
легко реагує з воднем над нікелевим
каталізатором при температурах нижчих
100оС
з утворенням пропану:
Циклобутан у присутності каталізатора теж перетворюється на н.бутан, але для цього потрібна температура близько 200оС:
![]()
П’ятичленні цикли стійкіші й взаємодіють з воднем тільки при високих температурах з утворенням відповідних алканів:
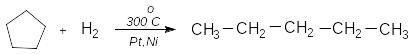
Циклогексан та його гомологи не гідруються, а при нагріванні над Pt, Pd або Ni вилучають водень (дегідруються) й перетворюються на бензен або його гомологи:
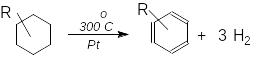
Цю реакцію використовують як метод ароматизації циклопарафінових гатунків нафти
