- •5. Фазовые равновесия
- •5.1. Основные понятия, определения, законы
- •5.1.1. Условия фазового равновесия
- •5.1.2. Фазовые равновесия в однокомпонентной системе
- •5.1.3. Равновесие пар–жидкость в двухкомпонентной системе
- •5.1.4. Равновесие жидкость–твёрдое в двухкомпонентной системе. Уравнение Шрёдера
- •5.2. Лабораторные работы
- •5.2.1. Работа ф-1. Определение зависимости давления насыщенного пара от температуры в однокомпонентной системе и расчёт теплоты парообразования
- •5.2.2. Работа ф-2. Равновесие жидкость – пар в двухкомпонетных системах
- •5.2.3. Работа ф-3. Построение фазовой диаграммы плавкости двухкомпонентной системы kno3–NaNo3.
- •5.3. Контрольные вопросы к работам ф-1, ф-2 и ф-3
5.1.4. Равновесие жидкость–твёрдое в двухкомпонентной системе. Уравнение Шрёдера
Допустим, что в двухкомпонентной двухфазной системе вещества 1 и 2 не образуют между собой твёрдого раствора, но полностью смешиваются в жидкой фазе, которую в дальнейшем будем считать идеальным раствором. Рассмотрим равновесие между одним из этих веществ находящимся в твёрдой фазе, образованной его кристаллами, и в составе жидкой фазы, которую при высокой температуре называют расплавом.
Из условия равновесия
![]() где i
= 1 или 2, следует
где i
= 1 или 2, следует
![]()
Отсюда
![]()
Продифференцируем обе части уравнения по температуре при постоянном давлении:
![]() где
где
![]() – стандартная энтальпия плавления
– стандартная энтальпия плавления
![]() -го
компонента.
-го
компонента.
Выражение
![]() (5.9)
(5.9)
которое для идеальных растворов выглядит как
![]() (5.10)
(5.10)
называется
уравнением
Шрёдера. Так
как энтальпия плавления всегда больше
нуля, то есть плавление сопровождается
поглощением тепла, то при образовании
идеального раствора растворимость
твёрдого тела в жидкости увеличивается
с ростом температуры. Если принять, что
не зависит от температуры, то при
интегрировании уравнения (5.10):
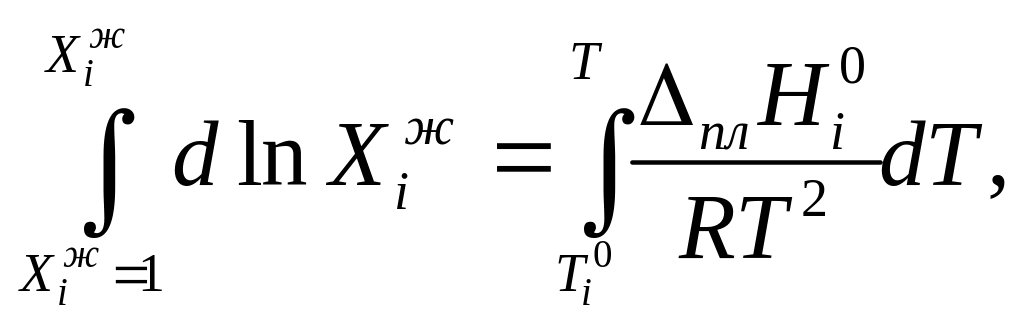 получим
получим
![]() (5.11)
(5.11)
где
![]() – температура плавления чистого
-го
компонента. Для двухкомпонентной системы
уравнение Шрёдера применимо в случае,
когда компоненты полностью смешиваются
в жидком состоянии (растворе, расплаве)
и совершенно не смешиваются в твёрдом.
– температура плавления чистого
-го
компонента. Для двухкомпонентной системы
уравнение Шрёдера применимо в случае,
когда компоненты полностью смешиваются
в жидком состоянии (растворе, расплаве)
и совершенно не смешиваются в твёрдом.
Для идеального
раствора энтальпия растворения
-го
компонента
![]() равна его энтальпии плавления
равна его энтальпии плавления
![]() ,
так как энтальпия смешения компонентов
при образовании идеального раствора
равна нулю.
,
так как энтальпия смешения компонентов
при образовании идеального раствора
равна нулю.
При образовании
неидеального раствора повышение
температуры может как увеличивать, так
и уменьшать растворимость вещества.
Если
![]() ,
то растворимость твёрдых тел увеличивается
с ростом температуры. Например, при
повышении температуры от 273 до 373 К
растворимость K2Cr2O7
в воде увеличивается в 21,3 раза. В
некоторых случаях энергия сольватации
компонента может быть больше энергии
кристаллической решетки, поэтому при
его растворении тепло выделяется,
,
то растворимость твёрдых тел увеличивается
с ростом температуры. Например, при
повышении температуры от 273 до 373 К
растворимость K2Cr2O7
в воде увеличивается в 21,3 раза. В
некоторых случаях энергия сольватации
компонента может быть больше энергии
кристаллической решетки, поэтому при
его растворении тепло выделяется,
![]() ,
и растворимость понижается при увеличении
температуры. Например, при повышении
температуры от 273 до 373 К растворимость
Ce2(SO4)3
в воде уменьшается в 38,2 раза. Если же
,
и растворимость понижается при увеличении
температуры. Например, при повышении
температуры от 273 до 373 К растворимость
Ce2(SO4)3
в воде уменьшается в 38,2 раза. Если же
![]() ,
то растворимость не зависит от температуры,
как при растворении V2O5
в воде.
,
то растворимость не зависит от температуры,
как при растворении V2O5
в воде.
При исследовании реальной двухкомпонентной системы для выявления областей существования и состава равновесных фаз требуется построение трехмерной диаграммы (температура, давление, концентрация одного из компонентов). Однако если рассматривать состояние системы при постоянном давлении, то можно проводить анализ по плоской диаграмме состояния Т–X. Вид плоской Т–X диаграммы плавкости определяется взаимной растворимостью компонентов в жидком и твёрдом состояниях, а также природой и температурой плавления дополнительных химических соединений, которые могут образовываться из компонентов системы.
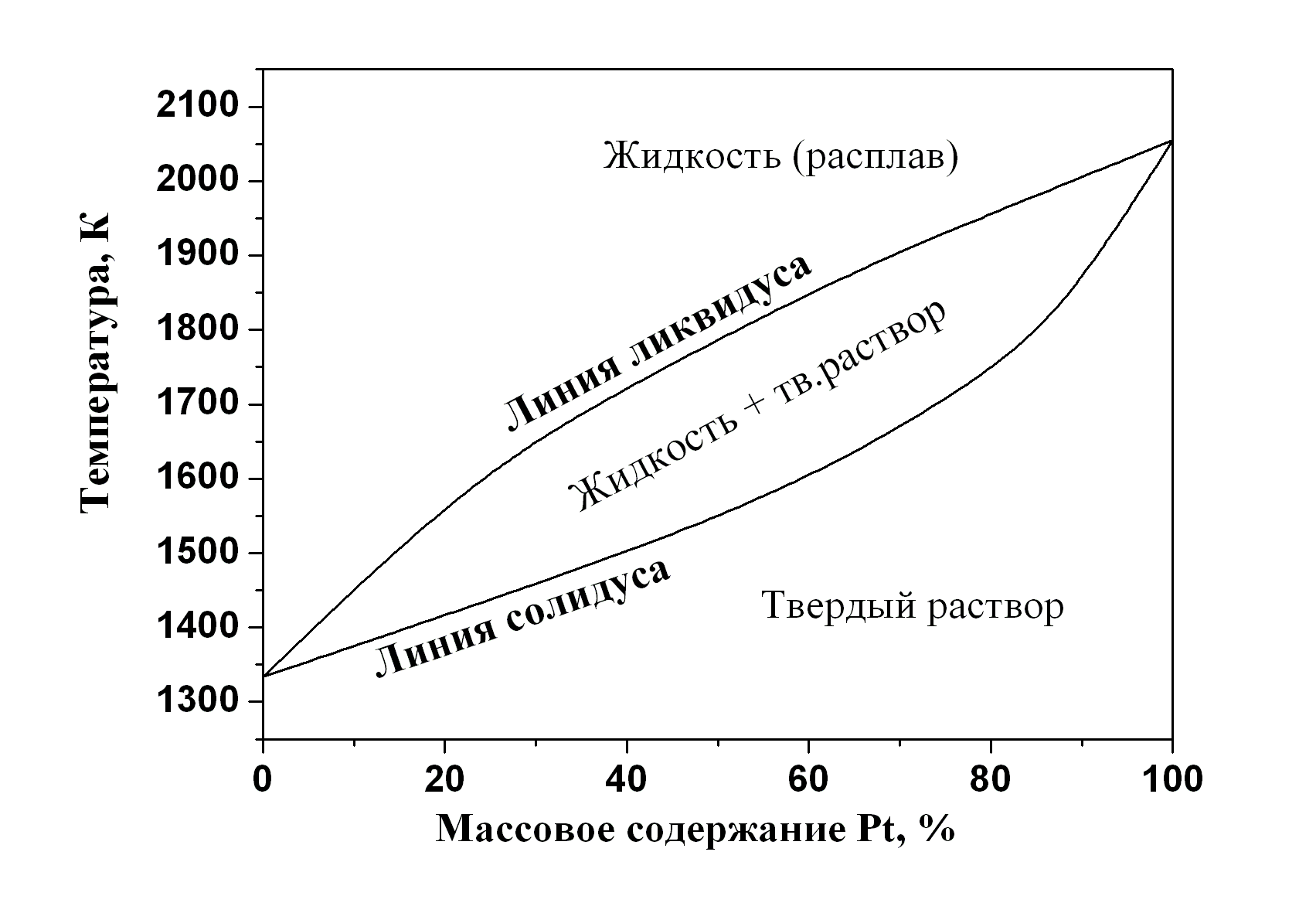
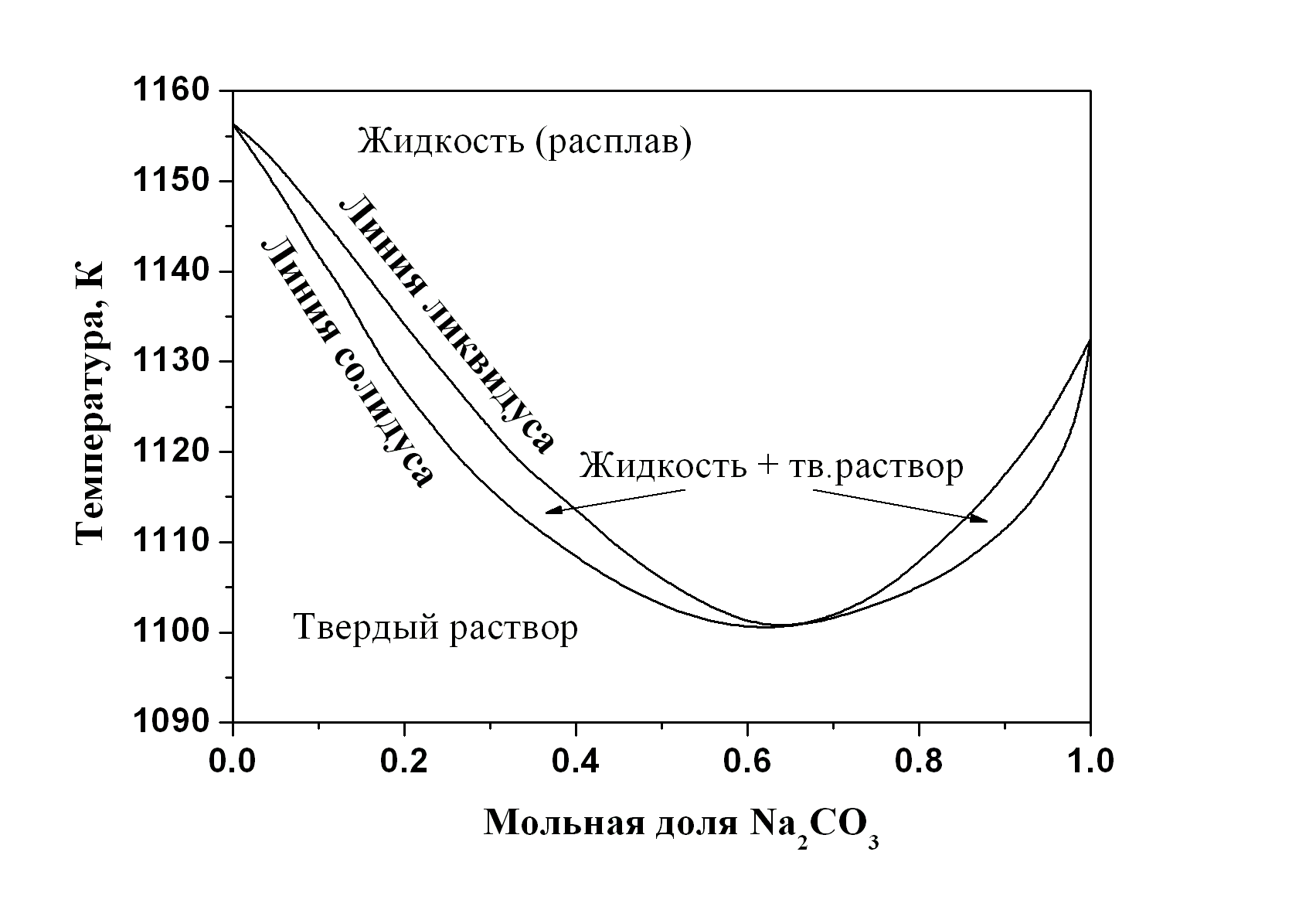
Рассмотрим основные типы диаграмм равновесия двухкомпонентных систем «твёрдое тело – жидкость». Наиболее простые диаграммы описывают двухкомпонентные системы, в которых не образуются химические соединения в твёрдом состоянии, и компоненты которых обладают неограниченной взаимной растворимостью в твёрдой и жидкой фазе. Диаграммы плавкости таких систем по виду аналогичны диаграммам «жидкость – пар» (рис. 5.2, 5.3). Диаграммы типа «линза» наблюдаются относительно редко, преимущественно в изоморфных системах, например, в системе фаялит (Fe2SiO4) + форстерит (Mg2SiO4), и в системах с некоторыми металлами: медь + никель, золото + платина, иттрий + скандий, иттрий + лантан, иттрий + титан (рис. 5.4-а). Встречаются диаграммы плавкости, аналогичные диаграммам пар–жидкость «с азеотропом», например, в системах геленит (Ca2Al2SiO7) + окерманит (Ca2MgSi2O7), карбонат натрия + сульфат натрия, кобальт + хром (рис. 5.4-б).
(а)
|
(б)
|
Рис. 5.4. Диаграммы плавкости двухкомпонентных систем с неограниченной взаимной растворимостью компонентов в твёрдой и жидкой фазах, P = 1 атм: а) Au + Pt, б) Na2CO3 + Na2SO4 |
|
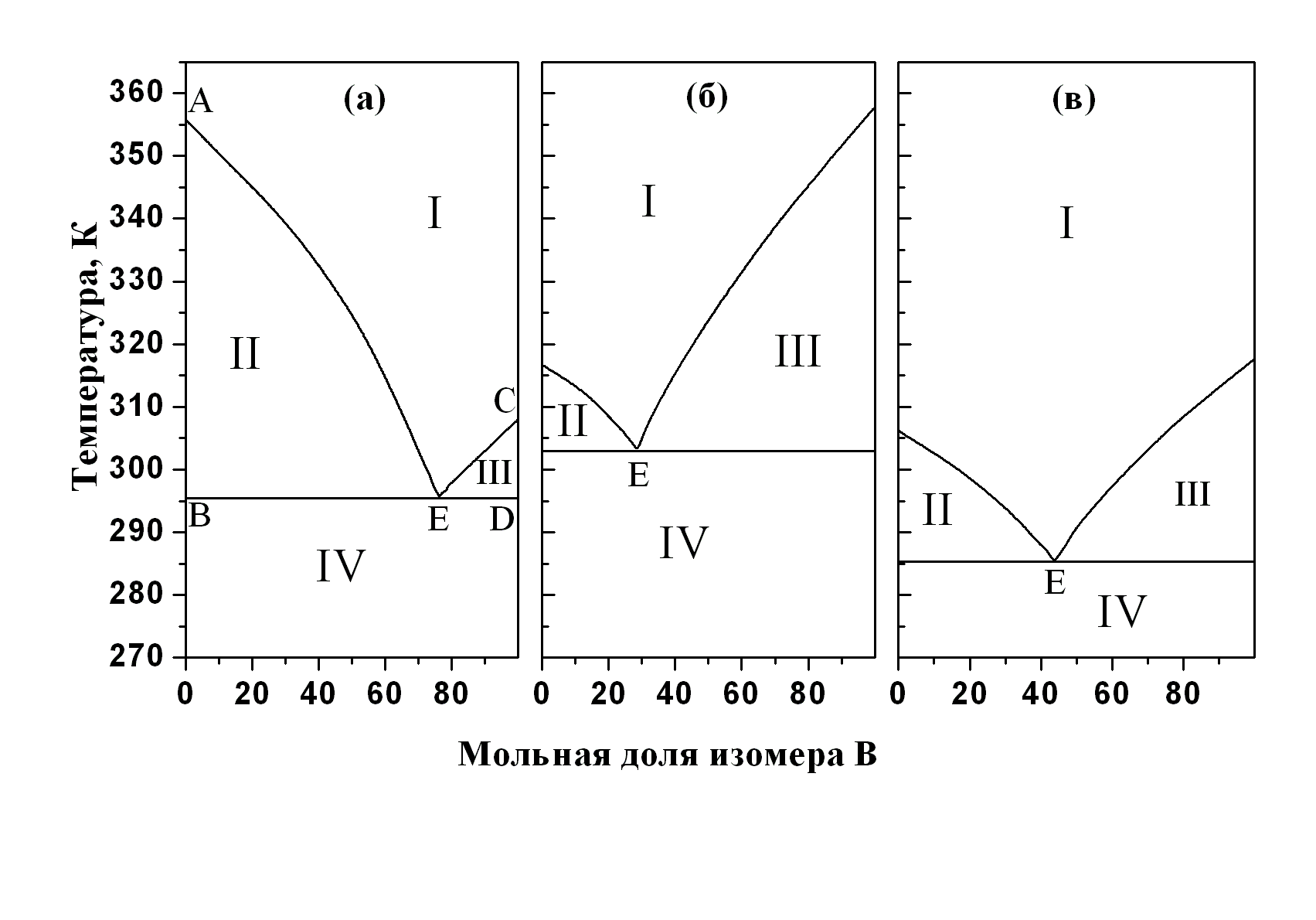
Другая группа диаграмм плавкости описывает двухкомпонентные системы, в которых также не образуются химические соединения, в жидкой фазе компоненты неограниченно растворимы, но твёрдые компоненты абсолютно не смешиваются. Вид этих диаграмм похож на диаграммы кипения смеси двух несмешивающихся жидкостей. Такие диаграммы имеют, например, системы: анорит (Ca[Al2Si2O8]) + диопсид (CaMg[Si2O6]), альбит (Na[AlSi3O8]) + фаялит (Fe2SiO4), лейцит (KAlSi2O6) + анорит (Ca[Al2Si2O8]). Они также характерны для большинства органических систем, поскольку даже изомеры, в том числе оптические, редко образуют смешанные кристаллы. Довольно часто такие диаграммы встречаются среди металлических и солевых систем, например, Ag + Pb, Zn + Sn, Bi + Cd, KCl + LiCl, AgBr + KBr, а также среди водных солевых систем (диаграммы растворимости), например, NH4Cl + H2O, NaNO3 + H2O. На рис. 38 приведены три диаграммы плавкости двухкомпонентных смесей мета-, орто- и пара-изомеров хлорнитробензола.
|
Рис. 5.5. Диаграммы плавкости «с простой эвтектикой» двухкомпонентных смесей с неограниченной взаимной растворимостью компонентов в жид-кой фазе и взаимной нерастворимостью в твёрдом состоянии на примере смесей изомеров хлорнитробензола, P = 1 атм: а) пара (А) + орто (B), б) мета (А) + пара (B), в) орто (А) + мета (B) |
При охлаждении
расплава такой системы всегда
кристаллизуются чистые компоненты.
Однако в отличие от однокомпонентных
систем, кристаллизация или плавление
большинства двухкомпонентных систем
происходит не при постоянной температуре,
а в некотором температурном интервале,
который определяется составом системы.
На рис. 5.5-а точки А и С изображают
температуры плавления чистых пара- и
орто-изомеров хлорнитробензола,
соответственно. Кривые АЕ и СЕ характеризуют
равновесные температуры и составы
жидкого расплава, при которых из расплавов
начинается кристаллизация пара- и
орто-изомера, соответственно. Линии АЕ
и СЕ называются линиями
ликвидуса,
которые описываются уравнениями Шрёдера
(5.9–5.11). Минимальная температура, при
которой заканчивается кристаллизация
расплава любого состава или начинается
плавление твёрдой смеси двух взаимно
нерастворимых компонентов, называется
эвтектической
температурой.
Линия BD,
отвечающая эвтектической температуре,
ниже которой не может равновесно
существовать жидкая фаза, называется
линией
солидуса.
Точка Е называется эвтектической
точкой, а
расплав соответствующего состава –
эвтектическим
расплавом.
Смесь кристаллов, выпадающая из этого
расплава при эвтектической температуре,
называется эвтектической
смесью или
просто эвтектикой.
Эвтектика кристаллизуется при постоянной
температуре и в этом сходна с чистыми
компонентами. При изменении давления
меняются и температура плавления, и
состав эвтектики. Положение точки
эвтектики (температуру
и состав
![]() )
нетрудно вычислить из уравнения Шрёдера,
решая систему уравнений:
)
нетрудно вычислить из уравнения Шрёдера,
решая систему уравнений:
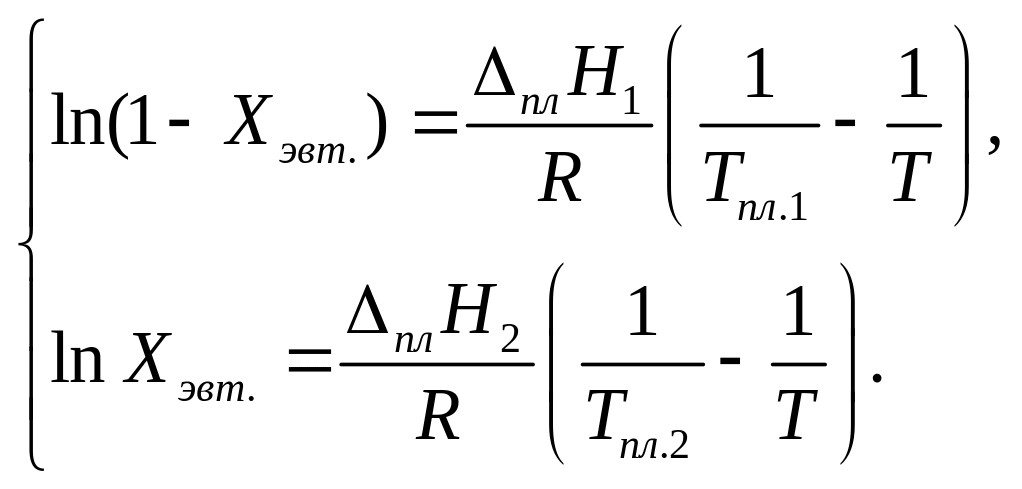 (5.12)
(5.12)
Линии ликвидуса и солидуса делят диаграмму плавкости на ряд областей: I – жидкий расплав, II – жидкий расплав и кристаллы компонента А, III – жидкий расплав и кристаллы компонента В, IV – механическая смесь двух чистых кристаллических компонентов А и В. Явления, связанные с образованием и свойствами эвтектик, известны очень давно и применяются для практических целей. Например, для пайки свинцовых водопроводных труб издавна применяли легкоплавкий припой – третник, состоящий из двух частей олова и одной части свинца, очень близкий по составу к эвтектическому сплаву этих металлов.
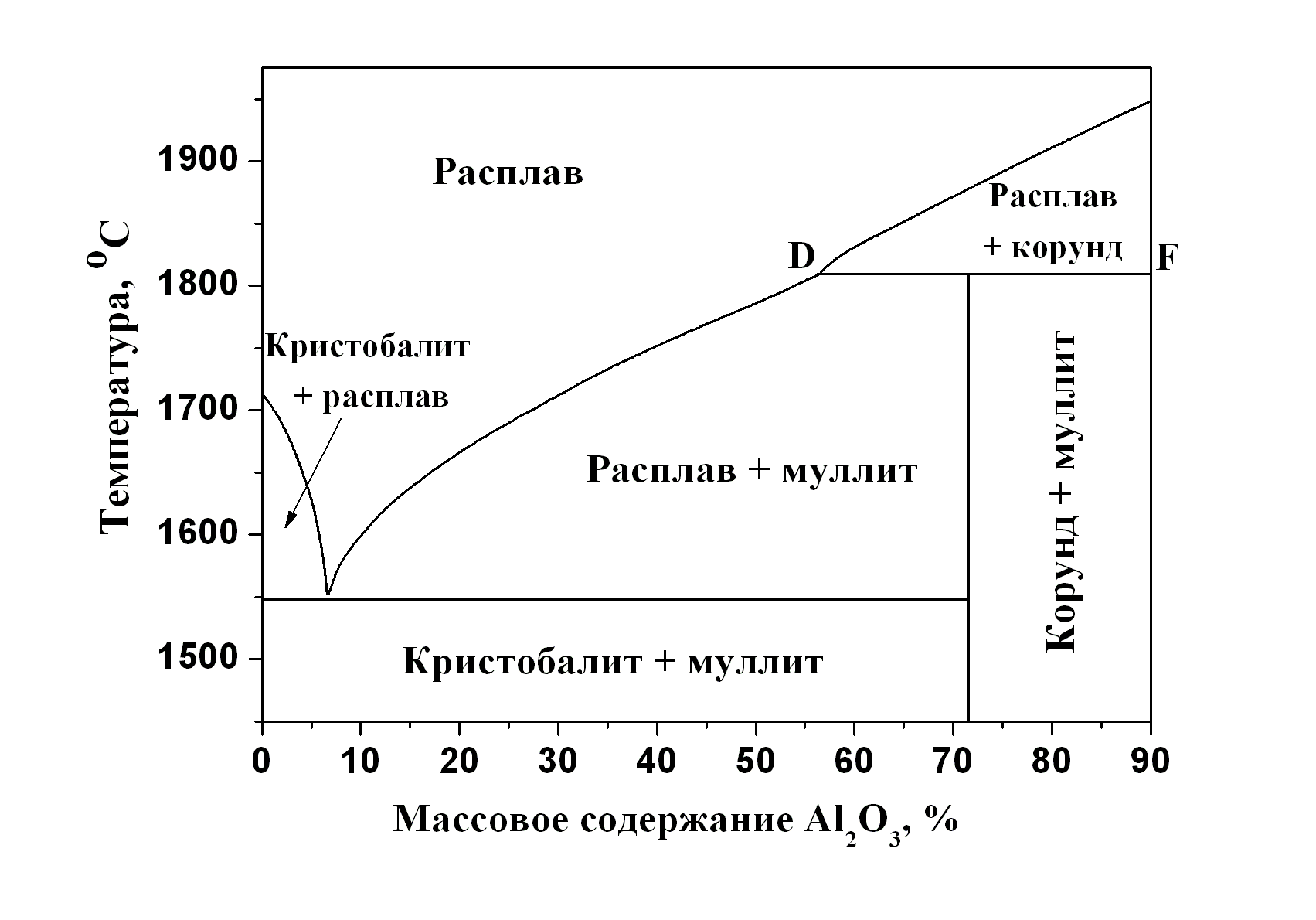
Часто встречаются системы, в которых компоненты образуют химические соединения. Эти соединения имеют свою точку плавления и при охлаждении смеси выпадают в виде кристаллов. Возможны два типа диаграмм плавкости систем, в которых образуются химические соединения: 1) с конгруэнтным плавлением и 2) с инконгруэнтным плавлением химического соединения.
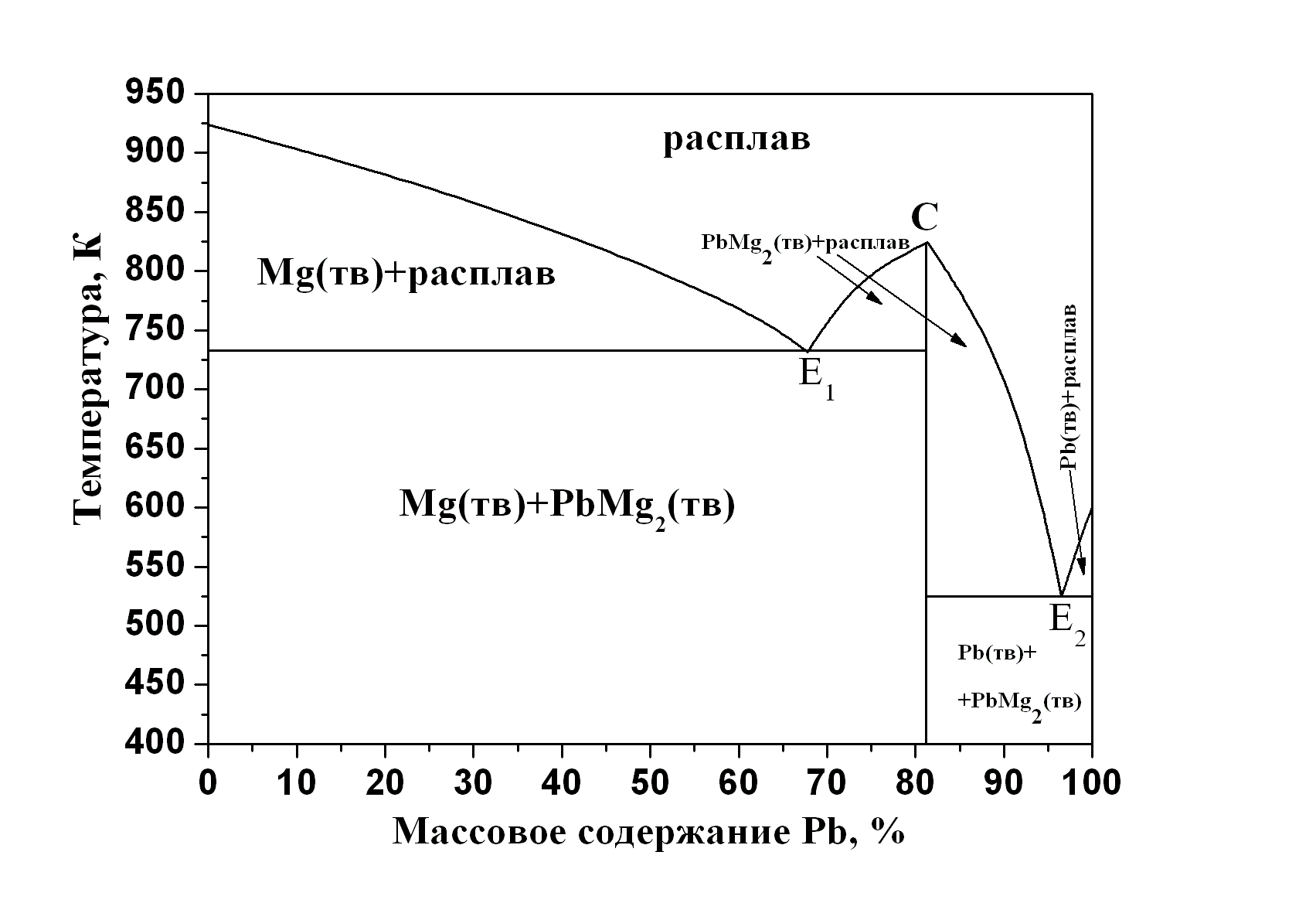
Первый тип описывает поведение систем, в которых твёрдое химическое соединение устойчиво вплоть до температуры плавления. В точке плавления состав образующейся жидкости совпадает с составом твёрдого химического соединения, из которого образовалась жидкость. Диаграмма плавкости системы с образованием одного химического соединения, плавящегося конгруэнтно, приведена на рис. 5.6-а. Эта диаграмма является сочетанием двух диаграмм плавкости, каждая из которых имеет одну эвтектику. Прибавление магния или свинца к химическому соединению PbMg2 приводит к понижению температуры кристаллизации из расплава химического соединения, в связи с этим линия ликвидуса конгруэнтно плавящегося соединения имеет максимум, отвечающий температуре плавления чистого PbMg2. На рис. 5.6-а этот максимум обозначен точкой С, которая называется дистектикой. Положение линии,
(а)
|
(б)
|
Рис. 5.6. Диаграммы плавкости двухкомпонентных смесей с неограниченной взаимной растворимостью компонентов в жидкой фазе и взаимной нерастворимостью в твёрдом состоянии, с образованием химического соединения: а) плавящегося конгруэнтно – система Mg + Pb, и б) плавящегося инконгруэнтно – система SiO2 + Al2O3 |
|
соответствующей
химическому соединению PbMg2,
на диаграмме плавкости определяется
из соотношения компонентов. Если по оси
Х отложены мольные доли, то
![]() ,
если отложены массовые доли, то
,
если отложены массовые доли, то
![]() ,
где
,
где
![]() ,
,
![]() – стехиометрический коэффициент и
молекулярная масса соответствующего
компонента в химическом соединении.
– стехиометрический коэффициент и
молекулярная масса соответствующего
компонента в химическом соединении.
Второй тип диаграмм (с инконгруэнтным плавлением) соответствует системам, в которых образуется менее устойчивое химическое соединение, которое при нагревании начинает разлагаются прежде, чем достигнута температура его плавления. При этом состав жидкости не совпадает с составом твёрдого химического соединения, из которого эта жидкость образовалась. Диаграмма плавкости с инконгруэнтным плавлением показана на рис. 5.6-б. При образовании химического соединения, плавящегося инконгруэнтно, максимум, отвечающий температуре плавления этого соединения, не реализуется и попадает в область, находящуюся под линией ликвидуса. Химическое соединение, в данном случае муллит, устойчиво только до температуры 1810 °С (линия DF), при которой соединение распадается на жидкий расплав и кристаллы корунда. Точка D называется перитектикой. Примерами систем с одним инконгруэнтно плавящимся соединением являются смеси K + Na, Au + Sb, C6H5I + SbCl3.
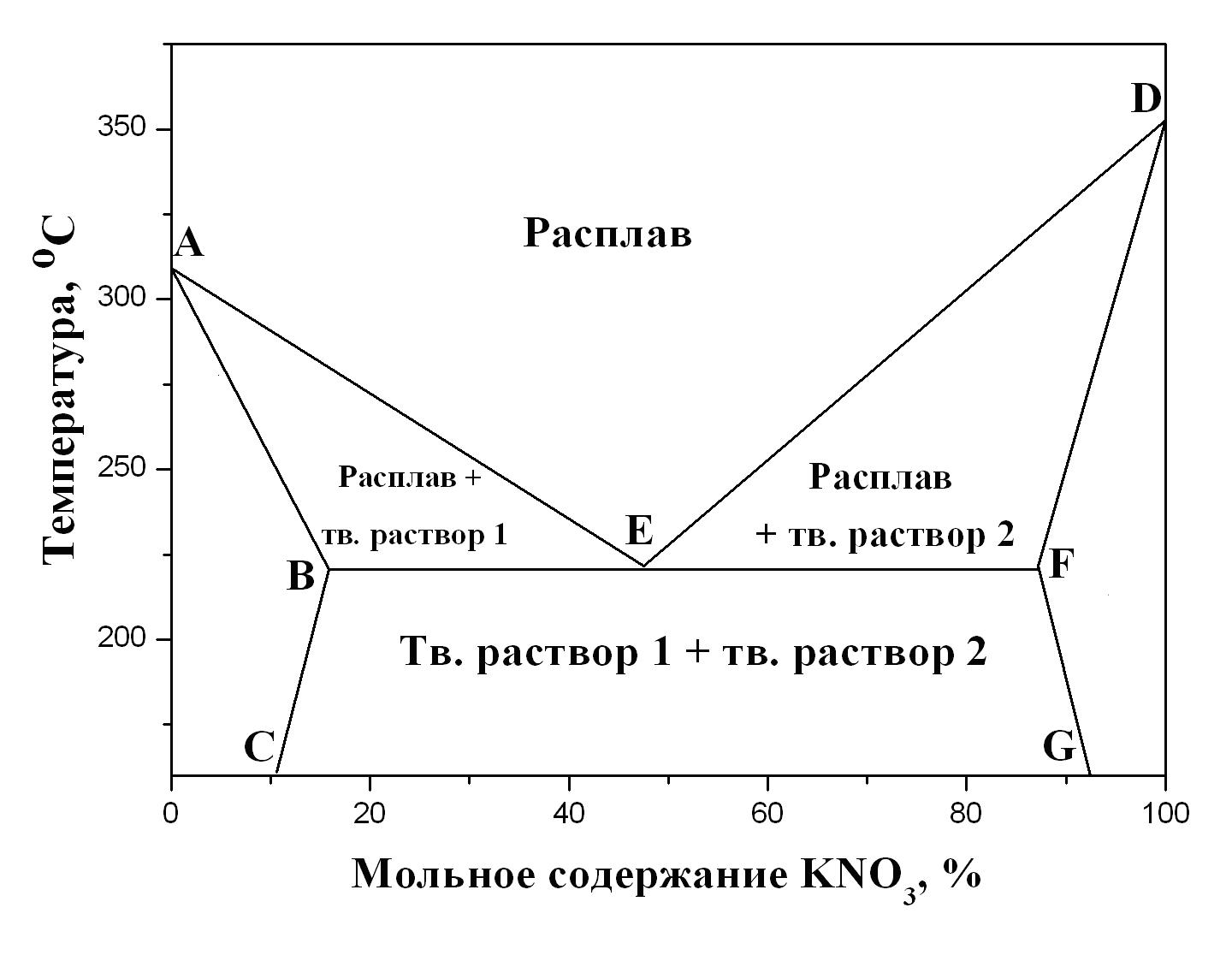
Часто встречаются системы, компоненты которых частично растворимы в твёрдом состоянии, например, при образовании твёрдых растворов замещения. В таких системах из расплавов кристаллизуются не чистые компоненты, а твёрдые растворы. Вид диаграмм систем с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твёрдом состояниях подобен диаграммам кипения ограниченно растворимых жидкостей. Пример одной из таких диаграмм плавкости приведен на рис. 5.7.
|
Рис. 5.7. Диаграмма плав-кости двухкомпонентной смеси NaNO3 + KNO3 с неограниченной взаимной растворимостью ком-понентов в жидком и ограниченной взаимной растворимостью в твёр-дом состояниях |
В ходе кристаллизации из расплава твёрдого раствора изменяется как состав расплава, определяемый по кривым AE или DE, так и состав твёрдого раствора, определяемый по кривым AB или DF. При температурах ниже линии BF равновесный состав сосуществующих твёрдых растворов определяется кривыми BC и FG. Подобные диаграммы наблюдаются в системах Bi + Pb, LiCl + AgCl и др.
Термический
анализ1.
Для построения
диаграмм плавкости применяется метод
термического анализа, основанный на
измерении температуры охлаждаемой (или
нагреваемой) смеси. Кривые температура
– время называются кривыми охлаждения
(нагревания). Если смесь заданного
состава расплавить, а затем медленно
охлаждать, то при отсутствии фазовых
переходов в системе её температура
будет понижаться плавно. При изменении
фазового состояния системы, например,
при выделении твёрдой фазы из жидкости,
переходе одной модификации в другую,
на кривых охлаждения появляются изломы
или горизонтальные участки. Рассмотрим
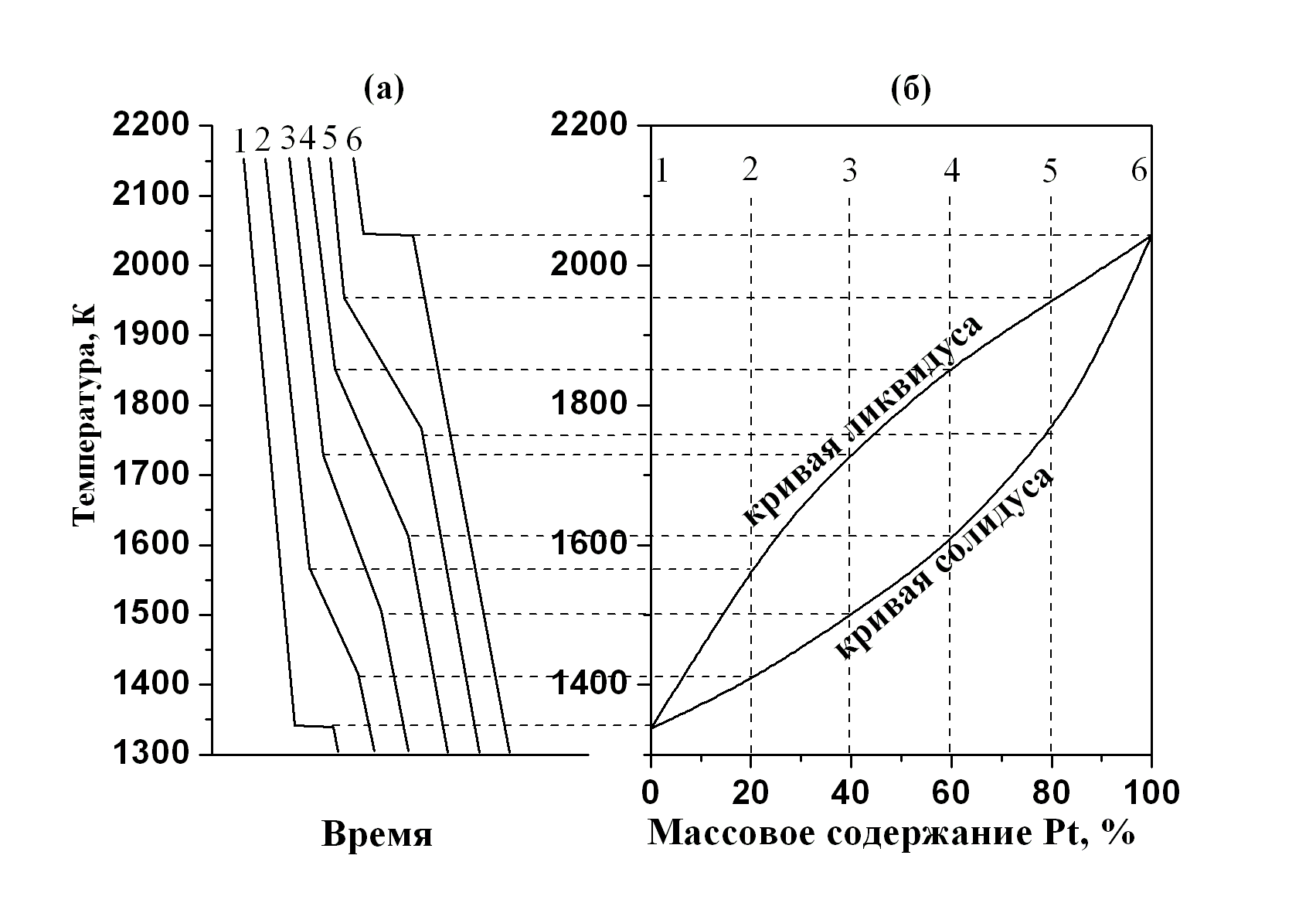
построение диаграммы плавкости системы
Au
+ Pt
(рис. 5.8б) на основании кривых охлаждения
при
![]() (рис. 5.8а). При охлаждении расплавов
(рис. 5.8а). При охлаждении расплавов
|
Рис. 5.8. Кривые охлаждения (а) и диаграмма плавкости (б) системы Au–Pt |
чистого золота (кривая 1 на рис. 5.8-а) и чистой платины (кривая 6 на рис. 5.8-а) до температуры их кристаллизации (1338 К и 2045 К, соответственно) наблюдается плавное понижение температуры расплава. При 1338 К и 2045 К начинается выпадение кристаллов Au и Pt, выделяющаяся теплота компенсирует потерю теплоты в окружающую среду, в результате чего температура образца остается неизменной, хотя температура печи понижается. После завершения кристаллизации температура вновь начинает снижаться. Это приводит к появлению плато на кривых 1 и 6.
Кривая 2 соответствует охлаждению системы, содержащей 20% платины. При 1567 К наблюдается снижение скорости охлаждения. Это объясняется тем, что начинается кристаллизация твёрдого раствора, сопровождающаяся выделением теплоты. При 1405 К скорость охлаждения снова увеличивается, потому что при данной температуре кристаллизация заканчивается и далее происходит охлаждение твёрдого раствора. На диаграмме T–X на вертикальной пунктирной линии, соответствующей составу 2, откладывается температура начала и конца кристаллизации (рис. 5.8-б). Аналогично находят точки начала и конца кристаллизации расплавов с другими составами смеси (кривые 3–5). Совокупность точек начала кристаллизации образует кривую ликвидуса, а совокупность точек конца
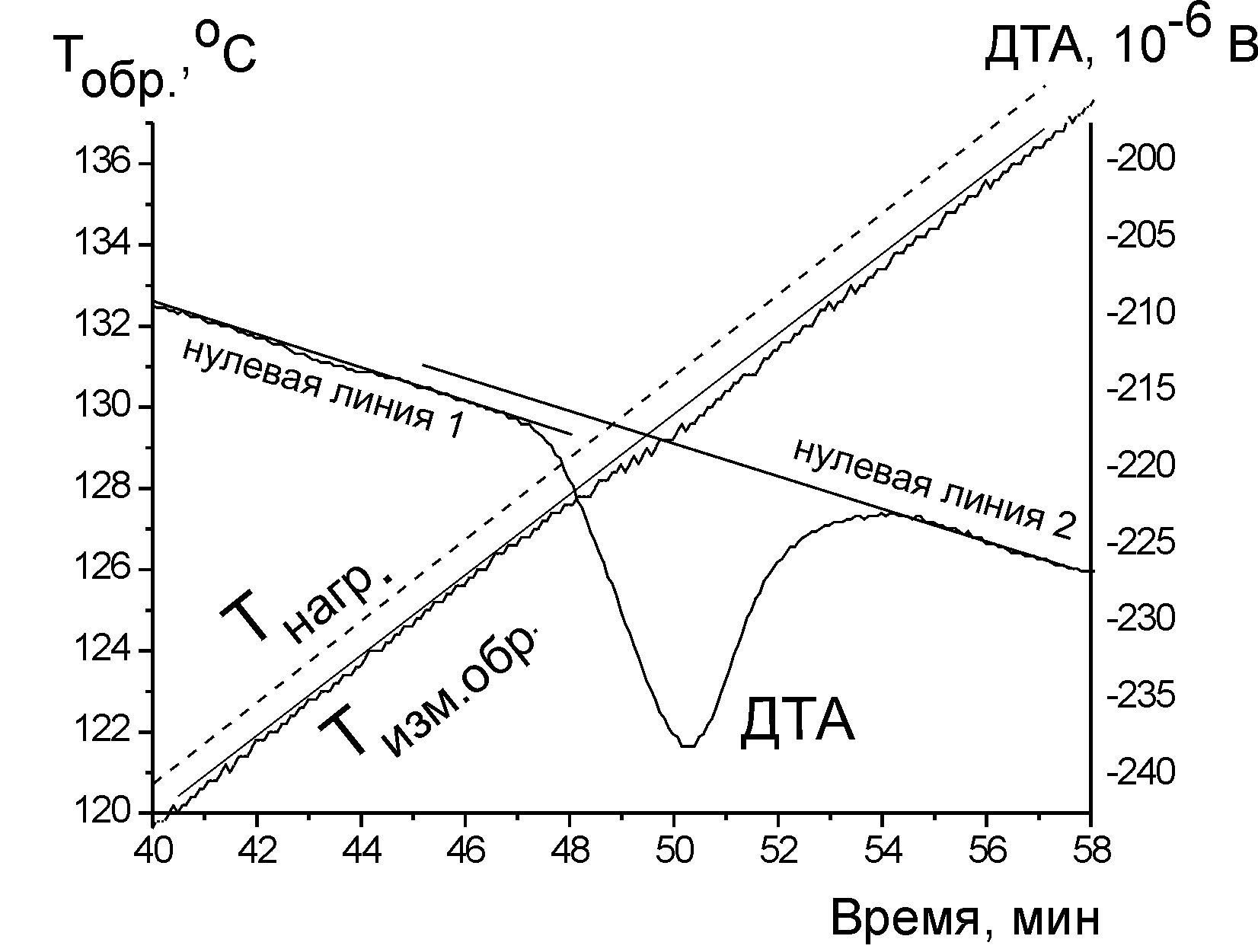
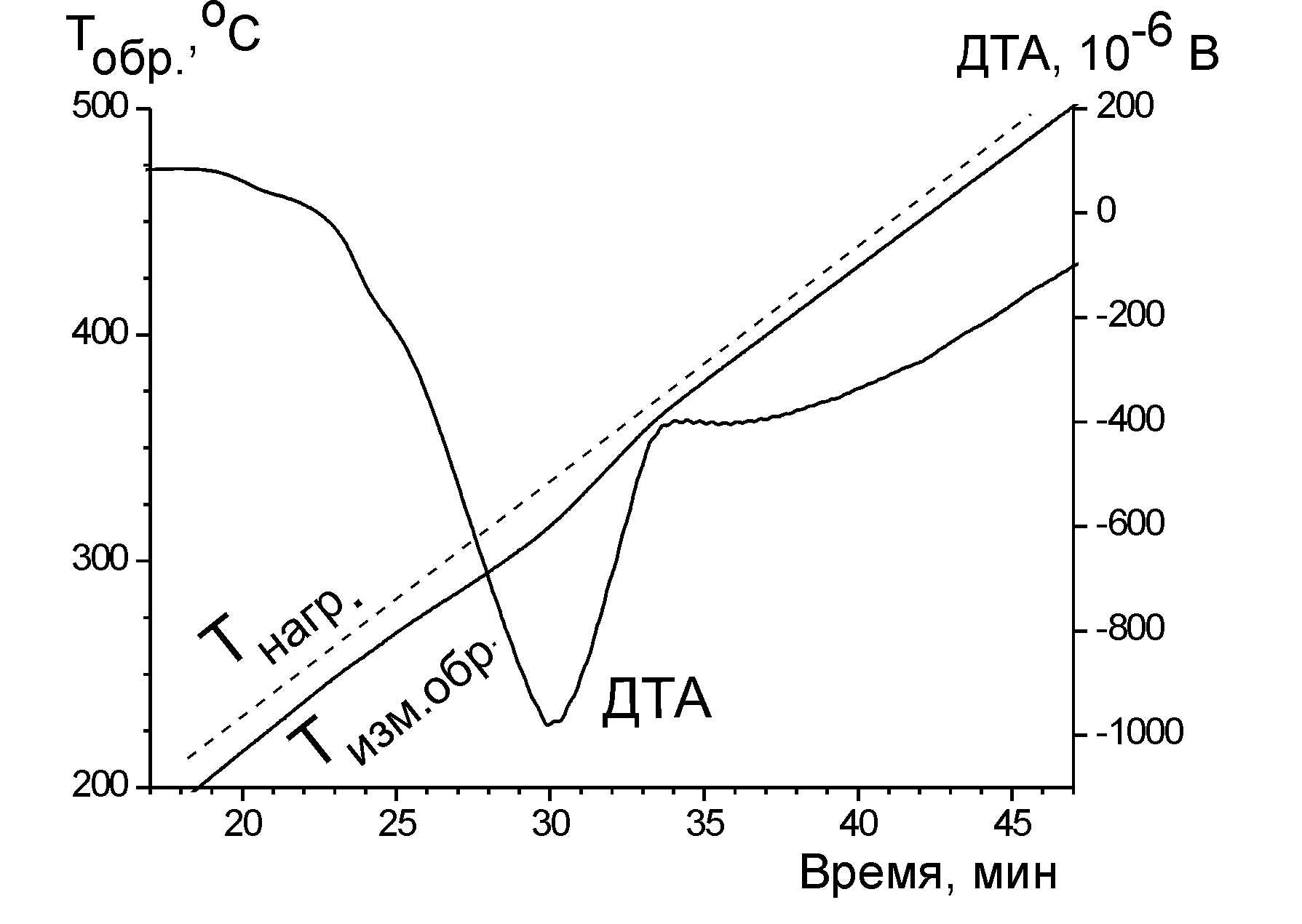
Рис. 5.9. Термограммы эндотермических процессов: (а) полиморфного превращения нитрата калия (скорость нагрева 1 К / мин, навеска образца 100 мг) и (б) разложения малахита, Cu2(OH)2CO3, (скорость нагрева 10 К / мин, навеска образца 100 мг). Tнагр. – температура печи, Tизм.обр – температура образца
кристаллизации – кривую солидуса. Изломы, наблюдаемые на кривых охлаждения, обычно невелики (рис. 5.9, кривые Tизм.обр). Для увеличения точности во всех приборах термического анализа предусмотрена возможность построения «дифференциальных кривых» (кривых ДТА). В некоторых случаях строится зависимость производной (dTизм.обр/dt), но в большинстве случаев дифференциальную кривую получают, непосредственно измеряя разность между температурой изучаемого образца и температурой эталонного вещества, в котором не происходит фазовых превращений. Таким путём получены кривые ДТА на рис. 5.9.