
- •Періодичний закон і періодична система хімічних елементів
- •Атомні радіуси деяких елементів, пм
- •Потенціали іонізації атомів деяких елементів (еВ)
- •Рис…. Залежність іонізаційних потенціалів атомів від протонного числа елемента
- •Рис….. Залежність молярного об'єму простих речовин від протонного числа елемента
Рис….. Залежність молярного об'єму простих речовин від протонного числа елемента
Цілком очевидно, що густина простих речовин змінюється залежно від протонного числа у зворотному порядку. Таким чином, якщо значення молярних об'ємів лужних металів максимальні, то густина їх має мінімальні значення.
Чітко виражена періодичність характерна для ентальпій атомізації простих речовин. Для елементів малих періодів крива залежності ентальпії атомізації від протонного числа проходить через максимум, що припадає на елементи ІVа підгрупи. Це зумовлено, з одного боку, збільшенням числа валентних електронів від одного до чотирьох, а з другого — зменшенням міцності кристалічної ґратки за рахунок зменшення КЧ ковалентних структур за правилом Юм-Розері (8 — N, де N — номер групи) після ІVа підгрупи. Мінімуми на кривій відповідають кристалам інертних газів, утворених за рахунок слабких сил міжмолекулярної взаємодії.
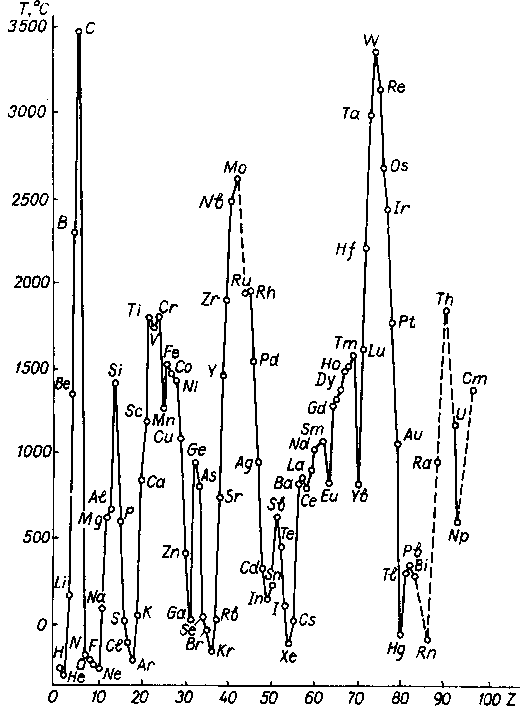
Якісна кореляція з характером зміни ентальпій атомізації спостерігається й у зміні температур плавлення простих речовин (рис. …), які також певною мірою зумовлені порівняльною міцністю зв'язків у кристалах. Із графіка видно, що кожний період починається простою речовиною з низькою температурою плавлення (лужні метали), але зі збільшенням протонного числа елементів у періоді температура плавлення зростає, проходить через максимум (або мінімум) і далі знижується, досягаючи мінімальних значень у кінці періоду (інертні гази).
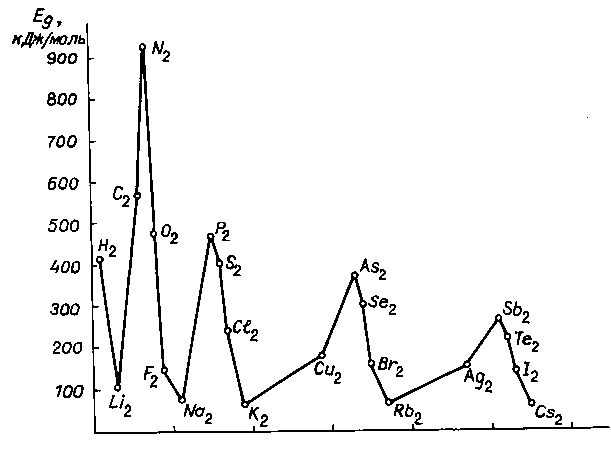
У елементів малих періодів температури плавлення знижуються, а для d-елементів спостерігається складніша залежність. На початку і в кінці вставних декад (Sc, Y, La i Zn, Cd, Hg) зверху донизу температури плавлення зменшуються, а в середині (Cr,Mo, W) збільшуються. Періодичність виявляється і в енергіях дисоціації двохатомних молекул (рис....).
Якщо енергія атомізації характеризує міцність зв’язків у кристалах, то енергія дисоціації є аналогічною характеристикою молекул. Мінімальні значення енергії дисоціації мають лужні метали, а максимальні – молекули елементів підгрупи Нітрогену, де реалізується потрійний зв'язок. Молекула азоту взагалі є найміцнішою з двохатомних молекул. Для халькогенів і галогенів енергії дисоціації закономірно зменшуються у межах кожного періоду, що відповідає утворенню подвійних і одинарних зв'язків.
Взаємодія за участю простих речовин неодмінно є окисно-відновною. Отже, для простих речовин два види взаємодії (кислот-но-основна та окисно-відновна) зливаються разом.
Відносна активність металів оцінюється значеннями стандартних електродних потенціалів у ряді напруг. Оскільки ряд напруг характеризує поведінку металу у водному розчині, що ускладнюється явищем гідратації, то його очолює літій, електродний потенціал якого негативніший, ніж у всіх лужних металів, а натрій поступається кальцію, хоч це положення не відповідає відносній хімічній активності елементів. Тому для однозначної оцінки активності металу обов'язково треба конкретизувати, у якому Стані і за яких умов він бере участь у взаємодії.
Відновна активність простих речовин тим більша, чим менші енергії їх сублімації та іонізації відповідних атомів. Періодична залежність зміни цих величин від протонного числа відповідних елементів зумовлює й періодичну залежність відновної активності простих речовин. Кожний період починається лужним металом з високою відновною активністю, але зі збільшенням протонного числа елементів у періоді відновна активність простих речовин послаблюється. У малих періодах це послаблення відбувається монотонно, і до кінця періоду відновна (металічна) активність знижується до нуля. У великих періодах значення відновної активності, спадаючи, проходять через мінімум у підгрупах Ванадію та Хрому, потім зростаючи, проходять через максимум у підгрупі Цинку й зменшуються, досягаючи мінімальних значень у кінці періодів. У всіх головних і побічних підгрупах III і IV груп значення відновної активності зі збільшенням протонного числа відповідних елементів зростають, а у решти побічних підгруп — зменшуються.
Окисна здатність (неметалічність) простих речовин тим більша, чим більша енергія спорідненості до електрона відповідних атомів і чим менша енергія дисоціації молекул простих речовин. Кожний період починається металами, що не мають окисної здатності. Вона з'являється у простих речовин елементів IVа підгрупи, зі збільшенням протонного числа елементів зростає і досягає максимальних значень у VII а підгрупі, після чого спадає до нуля.
Властивості складних речовин також періодично змінюються зі зростанням протонного числа елементів, але закономірності у зміні властивостей для них значно складніші, ніж для елементів і простих речовин.
З металами та неметалами генетичне пов'язані відповідні ряди характеристичних сполук — оксидів і гідроксидів. Характерною особливістю цих рядів є їх здатність до взаємної нейтралізації. Чим яскравіше виражені металічні й неметалічні властивості простих речовин, тим активніша взаємодія між ними та їхніми характеристичними сполуками. Однак, кислотно-основна взаємодія між цими сполуками відбувається без зміни ступеня окиснення елементів.
Аналогічні міркування стосуються і сполук, що містять зв'язок Е—Н. Якщо наближено вважати даний зв'язок іонним, то можна зробити висновок, що він буде тим міцнішим; чим вищий за абсолютним значенням ступінь окиснення елемента й чим менший радіус його іона. Отже, підсиленню кислотності водневих сполук сприяє зменшення (за абсолютним значенням) ступеня окиснення елемента та збільшення радіуса його іона.
Порівнюючи властивості простих речовин, а також водневих і кисневих сполук елементів, можна зробити висновки: хімічні властивості простих речовин у періодах змінюються від металічних через проміжні до неметалічних; елементи (крім Гелію, Неону та Аргону) утворюють водневі та кисневі сполуки, фізичні властивості яких змінюються від твердих до газуватих (LiН і NаН, ВеН2 і МgН2 — тверді гідриди; СН4 і SіН4, NН3 і РН3 — газуваті водневі сполуки; Li2О і Nа2О, ВеО і МgО — тверді оксиди; СО2, NO2, SО2 — газуваті оксиди). Склад найвищих солетвірних оксидів елеменів визначається номером групи. Леткі водневі сполуки певного складу утворюють лише неметали; у періодах зліва направо основний характер оксидів і гідроксидів поступово послаблюється, поступаючись амфотерному. До кінця періодів посилюються кислотні властивості; у головних підгрупах (крім VIII) зверху донизу посилюється основний характер оксидів і гідроксидів, а кислотні властивості послаблюються.
У кожній сукупності вільних атомів, складних і простих речовин є свої специфічні особливості, своя класифікація, що значно ускладнює завдання графічного вираження періодичного закону та системи хімічних елементів.
