
- •Физиология мышечного сокращения
- •Морфо-функциональная характеристика мышечной ткани
- •Строение сократительного аппарата мышечных волокон разных типов
- •Механизм мышечного сокращения (теория скользящих нитей х. Хаксли и э. Хансон)
- •Типы мышечных сокращений
- •Понятие о двигательной (нейромоторной) единице. Типы двигательных единиц
- •Сравнительная характеристика физиологических и электрофизиологических особенностей скелетных и гладких мышечных волокон
- •Режимы работы скелетных мышц
- •Теплопродукция скелетных мышц
Строение сократительного аппарата мышечных волокон разных типов
Сократительный аппарат скелетного и сердечного мышечных волокон представлен миофибриллами – довольно крупными нитями (диаметр – 1-2 мкм, а длина может варьировать в зависимости от длины волокна), состоящими из более мелких нитей – протофибрилл (миофиламентов) двух типов – тонких (актиновых) и толстых (миозиновых), которые определенным образом уложены в составе миофибриллы. Количество миофибрилл в каждом скелетном мышечном волокне составляет 1000-2000. Причем в составе одной миофибриллы насчитывается до 2500 протофибрилл.
Тонкие или актиновые филаменты (диаметр – 5-6 нм, длина – 1 мкм) состоят из трех типов белков (определенным образом уложенных друг относительно друга):
G-актина (глобулярный белок), полимеризация молекул которого приводит к образованию фибриллярного (нитчатого) актина (F-актина), имеющего вид спирали с желобком (суперспираль – надмолекулярная структура). Причем в составе каждого актинового филамента имеются две суперспирали F-актина, в желобках которых, в свою очередь, последовательно уложены:
молекулы фибриллярного тропомиозина (нитчатый белок), к концам которого примыкают
молекулы тропонина (глобулярный белок).
Толстые или миозиновые филаменты (диаметр – 10 нм, длина – 1,6 мкм) образованы преимущественно молекулами белка миозина. Белок миозин, в свою очередь, является гексомером (состоит из 6 субъединиц). Причем 2 субъединицы образуют нитчатый хвост молекулы, а остальные четыре – две миозиновые головки. Таким образом, у каждого миозинового филамента имеется один хвост (нитчатый) и две головки (глобулярные).
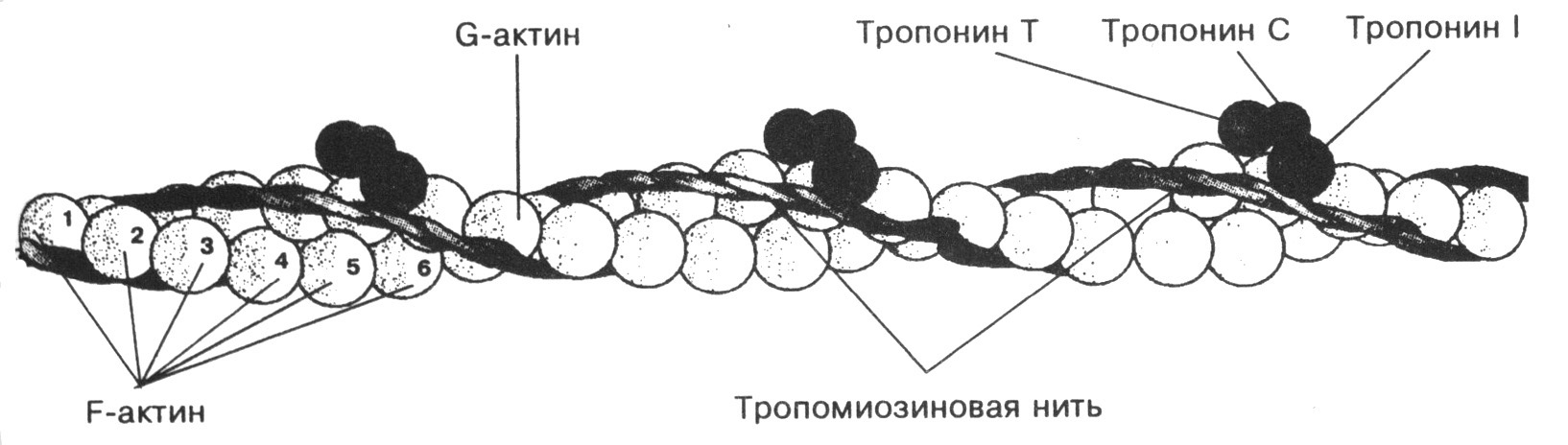
Рис. 6. Схема строения тонкого (актинового) филамента
С функциональной точки зрения в миозиновой молекуле выделяют:
головку (фрагмент S1), определенный участок которой обладает активностью фермента АТФгидролазы (АТФазы); причем в отсутствии взаимодействия миозиновой головки с актином ее АТФазная активность очень низкая,
шейку (фрагмент S2, небольшой начальный участок нитчатых субъдиниц молекулы миозина, образующих хвост молекулы длиной 55 нм, который ассоциирован с субъединицами, образующими головки)
и собственно хвост (концевая часть нитчатых субъединиц миозиновой молекулы длиной 100 нм).

Рис. 7. Схема строения толстого (миозинового) филамента
Головка миозиновой молекулы вместе с шейкой образуют т.н. тяжелый меромиозин, а собственно хвост – легкий меромиозин.
В области присоединения головки миозиновой молекулы к шейке и шейки – к хвосту имеются по шарнирному участку (всего в молекуле их получается два), позволяющих миозиновой молекуле изменять свою конформацию (пространственную структуру).

Рис. 8. Схема строения молекулы миозина
Таким образом, миозиновая нить состоит из большого количества миозиновых молекул, в каждой из которых выделяют один хвост и две глобулярные головки. Миозиновые молекулы уложены в составе миозинового миофиламента (протофибриллы) так, что их хвосты обращены к центру нити (миозиновые молекулы в составе миозиновой нити обращены друг к другу своими хвостами), а головки – находятся на обеих периферических концах нити.
А ктиновые
и миозиновые миофиламенты (протофибриллы)
определенным образом уложены друг
относительно друга в составе миофибриллы,
так что образуются регулярно чередующиеся
по ее длине темные (анизотропные,
А-диски) и светлые (изотропные,
I-диски)
диски. I-диски
состоят только из параллельно уложенных
актиновых филаментов. Причем в
центре каждого светлого диска проходит
Z-мембрана
– узкая темная полоска белковой природы,
к которой крепятся одним своим концом
актиновые нити; другой же конец актиновых
филаментов является свободным и направлен
в пространства между миозиновыми нитями.
Темные (А) диски состоят из параллельно
уложенных миозиновых филаментов,
в пространства между которыми входят
своими концами актиновые филаменты.
В центре темных дисков находится М-линия
(мезофрагма) белковой природы,
которая объединяет центральные части
миозиновых нитей друг с другом. Зона в
темном диске, состоящая только из
миозиновых нитей (лишенная актиновых),
называется H-зоной; ее
ширина может изменяться в зависимости
от степени укорочения миофибриллы и
волокна в целом.
ктиновые
и миозиновые миофиламенты (протофибриллы)
определенным образом уложены друг
относительно друга в составе миофибриллы,
так что образуются регулярно чередующиеся
по ее длине темные (анизотропные,
А-диски) и светлые (изотропные,
I-диски)
диски. I-диски
состоят только из параллельно уложенных
актиновых филаментов. Причем в
центре каждого светлого диска проходит
Z-мембрана
– узкая темная полоска белковой природы,
к которой крепятся одним своим концом
актиновые нити; другой же конец актиновых
филаментов является свободным и направлен
в пространства между миозиновыми нитями.
Темные (А) диски состоят из параллельно
уложенных миозиновых филаментов,
в пространства между которыми входят
своими концами актиновые филаменты.
В центре темных дисков находится М-линия
(мезофрагма) белковой природы,
которая объединяет центральные части
миозиновых нитей друг с другом. Зона в
темном диске, состоящая только из
миозиновых нитей (лишенная актиновых),
называется H-зоной; ее
ширина может изменяться в зависимости
от степени укорочения миофибриллы и
волокна в целом.
Рис. 9. Схема строения миофибриллы
Структурно-функциональной единицей миофибриллы является саркомер – ее участок между двумя соседними Z-мембранами. Таким образом, саркомер включает половину одного диска I, диск А и половину следующего за диском А светлого I-диска (саркомер состоит из 1/2I-диска+ A-диск + 1/2I-диска).
Все миофибриллы в составе волокна уложены таким образом, что темные диски одной находятся строго под темными дисками другой Каждая миофибрилла окружена цистернами СР. Кроме того, цистерны СР располагаются и под плазмолеммой. Причем место контакта Т-трубочки с боковыми цистернами СР у млекопитающих животных и человека соответствует границе А- и I-дисков.
Сократительный аппарат гладкого мышечного волокна представлен актиновыми и миозиновыми протофибриллами, диффузно рассеянными в цитоплазме и не образующими миофибрилл. Причем актиновые филаменты через посредство плотных телец (белковой природы) фиксируются прямо к плазмолемме гладкомышечной клетки (т.е. здесь функциональным аналогом Z-мембраны миофибрилл выступают плотные тельца в комплексе с плазмолеммой волокна).
