
2.1.Давление насыщенного пара растворителя
Давление пара над раствором нелетучего вещества в каком-либо растворителе всегда ниже, чем над чистым растворителем при одной и той же температуре. Согласно закону Рауля (I закон), относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества:
![]() ,
где
,
где
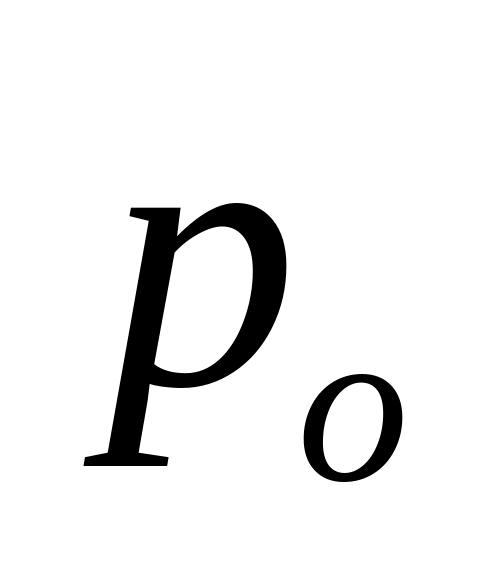 -давление
пара над чистым растворителем, Па;
-давление
пара над чистым растворителем, Па; -
давление пара растворителя над раствором
нелетучего вещества, Па; /
-
давление пара растворителя над раствором
нелетучего вещества, Па; / /–
абсолютное понижение давления пара
над раствором, Па. Величина
/–
абсолютное понижение давления пара
над раствором, Па. Величина
 - относительное понижение давления
пара над раствором.
- относительное понижение давления
пара над раствором. -
молярная доля растворенного вещества
(Х), которая определяется по формуле:
-
молярная доля растворенного вещества
(Х), которая определяется по формуле:
 ,
где
,
где
 -
число молей растворенного вещества;
-
число молей растворенного вещества;
 -
число молей растворителя. Величина
-
число молей растворителя. Величина
 – мольная доля растворенного вещества.
– мольная доля растворенного вещества.Число молей растворенного вещества и растворителя можно находить по формулам:
 или
или
 .
.Отсюда можно найти:
 и
и

Таким образом,
относительное понижение давления пара
растворителя над раствором (или депрессия
раствора) зависит только от концентрации
раствора, но не зависит от температуры.
Для разбавленных растворов
по сравнению
мало и поэтому его величиной в знаменателе
уравнения:
можно пренебречь
и тогда закон Рауля примет вид:
![]()
![]() .
.
Закон Рауля точно соблюдается только для идеальных растворов и приближенно для разбавленных реальных растворов: чем разбавленнее раствор, тем более он приближается к идеальному.
2.2. Температура кипения и замерзания растворителя и раствора (II закон Рауля)
Изучая кипение и замерзание растворов, Рауль (1882) установил, что повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов пропорционально моляльности растворов. Эта закономерность называется вторым законом Рауля и его математическим выражением являются уравнения:
![]()
![]()
![]()
![]()
![]() -
моляльность
раствора;
-
моляльность
раствора;
![]() - эбуллиоскопическая
постоянная растворителя (от лат.
«ebbulire»
— выкипать);
- эбуллиоскопическая
постоянная растворителя (от лат.
«ebbulire»
— выкипать);
![]() - криоскопическая
постоянная растворителя (от греч. «криос»
- холод);
- криоскопическая
постоянная растворителя (от греч. «криос»
- холод);
![]() -
температура кипения и замерзания
раствора;
-
температура кипения и замерзания
раствора;
![]() – температура
кипения и замерзания чистого растворителя.
– температура
кипения и замерзания чистого растворителя.
Постоянные константы и не зависят от природы растворенного вещества, а характеризуют лишь растворитель. Справочные значения констант и для некоторых растворителей приведены в таблице (см. приложение 6).
На измерениях температур кипения и замерзания основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ:
![]()
![]()
Второй закон Рауля иногда называют следствием первого. Ряд ученых подразделяют все закономерности, установленные Раулем на три закона:
тоноскопический (понижение давления пара над раствором);
криоскопический (понижение температуры замерзания раствора);
эбуллиоскопический (повышение температуры кипения раствора).
В целом, обобщенные формулы для разбавленных растворов электролитов и неэлектролитов имеют вид:
-
Д
 ля
растворов неэлектролитов
ля
растворов неэлектролитовДля растворов электролитов
1.

2.

3.

4.
1.
2.

3.

4.

