- •1. Острая перемежающаяся порфирия
- •2. Печеночно-клеточная, паренхима то зная (печеночная) желтуха.
- •3 Механическая,обтурационная (подпеченочная) желтуха.
- •40)Биосинтез пуриновых и пиримидиновых.
- •Типы репарации у бактерий имеются по крайней мере 2 ферментные системы, ведущие репарацию — прямая и эксцизионная.
- •Эксцизионная репарация
- •69) Фосфатиды-неглицериды.
Типы репарации у бактерий имеются по крайней мере 2 ферментные системы, ведущие репарацию — прямая и эксцизионная.
Прямая репарация
Прямая репарация наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Так действует, например, O6-метилгуанин-ДНК-метилтрансфераза, которая снимает метильную группу с азотистого основания на один из собственных остатков цистеина.
Эксцизионная репарация
Эксцизионная репарация (англ. excision — вырезание) включает удаление повреждённых азотистых оснований из ДНК и последующее восстановление нормальной структуры молекулы.
Ферментные системы Р., как полагают, принимают участие и в нормальной репликации ДНК, т. е. её удвоении. При репликации материнская ДНК деспирализуется (раскручивается), что может сопровождаться разрывами её нитей. Кроме того, дочерние цепи ДНК синтезируются в виде небольших фрагментов. Поэтому заключительная фаза репликации — Р. всех дефектов, возникших при синтезе ДНК. Важная функция второй системы Р. — её участие в образовании мутаций. Под действием различных мутагенов в ДНК образуются производные нуклеотидов, чуждые клетке. Они устраняются системой Р., которая заменяет их на нуклеотиды, естественные для ДНК, но иногда измененные по сравнению с первоначальными. Открытие Р. ДНК привело к коренным изменениям представлений о молекулярных механизмах, обеспечивающих стабильность генетического аппарата клеток и контролирующих темп мутационного процесса.
45 Главными источниками белков для человека являются пищевые продукты животного и растительного происхождения. В табл. 12.4 представлены средние данные о содержании белка в основных пищевых продуктах. Главным образом животные (мясо, рыба, сыр) и только некоторые растительные (горох, соя) продукты богаты белками, в то время как наиболее распространенные растительные пищевые продукты содержат небольшие количества его. Весь сложный процесс переваривания пищевых белков в пищеварительном тракте «настроен» таким образом, чтобы путем последовательного действия протеолитических ферментов лишить белки пищи видовой и тканевой специфичности и придать продуктам распада способность всасываться в кровь через стенку кишечника. Примерно 95–97% белков пищи всасывается в виде свободных аминокислот. Следовательно, ферментный аппарат пищеварительного тракта осуществляет поэтапное, строго избирательное расщепление пептидных связей белковой молекулы вплоть до конечных продуктов гидролиза белков – свободных аминокислот. Гидролиз заключается в разрыве пептидных связей —СО—NH— белковой молекулы. Протеолитические ферменты (протеиназы) обладают широкой специфичностью действия, определяемой как размером полипептида, так и структурой радикалов аминокислот, участвующих в образовании пептидной связи. Следует подчеркнуть, что с пищей человек получает огромное разнообразие белков, однако все они подвергаются воздействию ограниченного числа протеиназ. Эти ферменты относятся к классу гидролаз часто называются также пептидазами. Известны две группы пептидаз: экзопептидазы, катализирующие разрыв концевой пептидной связи с освобождением одной какой-либо концевой аминокислоты, и эндопеп-тидазы, преимущественно гидролизующие пептидные связи внутри полипептидной цепи. Эндопептидазы обладают разной субстратной специфичностью действия, всецело определяемой природой радикалов аминокислот по соседству с разрываемой пептидной связью, поэтому белковая молекула распадается под действием разных эндопептидаз на строго определенное число пептидов, сравнительно легко идентифицируемых методами хроматографии и электрофореза (метод отпечатков пальцев). Это свойство эндопептидаз нашло широкое применение в исследовательской работе при выяснении первичной структуры индивидуальных белков. Протеолитические ферменты ЖКТ: желудочный сок (пепсин, ренин, гастриксин), панкреатический сок (трипсин, химотрипсин, коллагеназа, карбокиспепсидаза, эластаза), кишечный сок (аминопептидаза, лейцинаминопептидаза, аланинаминопептидаза, энтнропептидаза, трипептидазы, дипептидазы, пропил-депиптидаза, пролин-дипептидаза). Проферметы. Протеолитические ферменты пищеварительного тракта, а также поджелудочной железы синтезируются в неактивной форме – в виде проферментов (зимогенов). Регуляция в этих случаях сводится к превращению проферментов в активные ферменты под влиянием специфических агентов или других ферментов – протеиназ. Так, трипсин в поджелудочной железе синтезируется в форме неактивного трипсиногена. Поступив в кишечник, он превращается в активный трипсин в результате аутокатализа или под действием других протеиназ. Превращение неактивного пепси-ногена в активный пепсин происходит аутокаталитически в результате специфического ограниченного протеолиза в присутствии соляной кислоты и также связано с отщеплением от профермента специфического ингибитора пептидной природы. Эти превращения зимогенов в активные ферменты связаны с конформационными изменениями молекулы фермента и формированием активного центра или его раскрытием (демаскирование). Синтез протеиназ в неактивной форме и ряда других неактивных белков-предшественников имеет, очевидно, определенный биологический смысл, предотвращая разрушение клеток органов, в которых образуются проферменты. Примерами подобного активирования белков является активирование некоторых гормонов (проинсулин —> инсулин), белка соединительной ткани (растворимый проколлаген превращается в нерастворимый коллаген), белков свертывающей системы крови. Соляной кислоте принадлежит значительная роль в желудочном пищеварении, так как она не только активирует ферменты, но и способствует перевариванию белков, вызывая их набухание и разрыхление. Соляная кислота желудочного сока вызывает денатурацию и набухание белков, подготавливая их к последующему расщеплению пепсинами; активирует пепсиногены; создает кислую среду, необходимую для расщепления пищевых белков пепсинами; участвует в антибактериальном действии желудочного сока и регуляции деятельности пищеварительного тракта. Органические компоненты желудочного сока представлены азотсодержащими веществами (200—500 мг/л): мочевиной, мочевой и молочной кислотами, полипептидами. Содержание белка достигает 3 г/л, мукопротеидов — 0,8 г/л, мукопротеаз — 7 г/л. Органические вещества являются продуктами секреторной деятельности желудочных желез и обмена веществ в слизистой оболочке желудка, а также экскретируются через нее из крови. Всасывание белков и аминокислот
У взрослого человека пищевые белки в неизмененом виде не всасываются. Только у новорожденного в первые дни жизни цельные белки молока поступают из кишечника в кровь , о чем свидетельствует появление в плазме ребенка материнских глобулинов , которые обеспечивают иммунитет .
После того, как в просвете кишечника завершается гидролитическое расщеплениее белков (см. Переваривание белков ), продукты этого расщепления (аминокислоты и олигопептиды) захватываются энтероцитами .
Всасывание аминокислот протекает с участием стереоспецифичных натрий-зависимых систем активного транспорта , расположенных в мембране энтероцита, обращенной в просвет кишечника. L-изомеры аминокислот переносятся легче, чем D-изомеры аминокислот . В настоящее время обнаружены четыре системы переноса аминокислот:
1. система переноса нейтральных аминокислот ( валина , фенилаланина , аланина ),
2. система переноса основных аминокислот ( аргинина , цистеина , лизина , орнитина ),
3. система переноса глицина и иминокислот ( пролина , гидроксипролина ),
4. система переноса дикарбоновых кислот ( глутаминовой кислоты и аспарагина ).
Существует взаимосвязь между транспортом некоторых аминокислот, проявляющаяся в виде взаимного торможения по типу конкурентного антагонизма (например, между глицином и метионином) или взаимного облегчения (например, между лизином и лейцином).
Всасывание олигопептидов тоже происходит путем активного транспорта , причем во многих случаях системы переноса олигопептидов работают быстрее, чем системы переноса аминокислот. Так, скорость транспорта некоторых дипептидов превышает скорость переноса тех аминокислот, из которых они состоят. Пептидазы щеточной каемки энтероцитов расщепляют значительную часть (около 40 - 60%) коротких пептидов лишь до ди- и трипептидов. Окончательный распад этих соединений до аминокислот происходит под действием пептидаз цитозоля.
Аминокислоты высвобождаются из энтероцита в области его базальной и боковых поверхностей. В их высвобождении участвуют многие механизмы пассивного транспорта - диффузия, облегченная диффузия и активный транспорт . В дальнейшем аминокислоты поступают в кровь и переносятся по портальной системе в печень .
Белки пищи начинают расщепляться в желудке под действием пепсина . Завершают их гидролиз в основном ферменты поджелудочной железы : эндопептидазы ( трипсин , химотрипсин ) и экзопептидазы ( карбоксипептидазы , аминопептидазы ). В итоге образуются олигопептиды, дипептиды и аминокислоты.
Олигопептиды гидролизуются олигопептидазами щеточной каемки . Дипептидазы же находятся как в щеточной каемке , так и в цитоплазме энтероцита . Дипептиды всасываются быстрее аминокислот, и, вероятно, их транспорт идет иначе.
Итак, гидролиз белков до аминокислот идет в 3 местах: в просвете кишки, в щеточной каемке и в цитоплазме энтероцита.
У взрослых крупные белки всасываются лишь в небольшом количестве; возможно, это имеет какое-то значение для попадания антигенов в организм.
Существует несколько систем транспорта аминокислот:
- для моноаминомонокарбоновых аминокислот (имеется общий белок-переносчик, за который аминокислоты, на пример триптофан и аланин, конкурируют друг с другом);
- для диаминомонокарбоновых аминокислот (аргинина, лизина и орнитина), а также цистина;
- для иминокислот (пролина и гидроксипролина);
- для моноаминодикарбоновых аминокислот (аспарагиновой и глутаминовой).
Некоторые аминокислоты могут связываться с разными белками-переносчиками, например, глицин - с переносчиками как моноаминомонокарбоновых аминокислот, так и иминокислот. Почти во всех случаях всасывание аминокислот происходит путем котранспорта с натрием.
№46 Перенос генетической информации- процесс непрерывный. Такое направление переноса генетич. информации через РНК к белку = центральным постулатом или центральной догмой молекулярной биолоии (Крик). Согласно ему не может быть переноса информации от белка к РНК, но допускается перенос от РНК к ДНК. Все виды передачи ген инф основаны на матричном мех-ме. При репликации матрицей служит одна из цепей ДНК. При транскрипции участок ДНК- прямая или мРНК-обратная. А при трансляции матричная РНК. Матрицей может быть только нукленовая к-та. Точность копирования соответствующей нуклеиновой матрицы обеспечивает правило комплиментарности азотистых оснований нуклеотидов. Согласно которым происходит спаривание А с Т или с У в РНК, и Г с Ц. благодаря этому порядок чередования нуклеотидов, в каждой новой полинуклеотидной цепи комплементарен матрице. Основу хромосом составляет 1 непрерывная 2-цепочечная молекула ДНК. Этапы трансляции:
1) инициация- это раскручивание ДНК
2) элонгация- синтез РНК на кодирующей цепочке
3) терминация – нонсенс кадоны УАА, УАГ.
47 При посттрансляционном созревании у многих белков удаляются части пептидной цепи или присоединяются дополнительные группы, например олигосахариды или липиды. Эти процессы происходят в эндоплазматическом ретикулуме и в аппарате Гольджи. Наконец, белки должны транспортироваться в соответствующую ткань или орган. Шаперо́ны (англ. chaperones) — класс белков, главная функция которых состоит в восстановлении правильной третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов. Термин «молекулярный шаперон» впервые был использован в работе Ласкей и других при описании ядерного белка нуклеоплазмина, способного предотвращать агрегирование белков-гистонов с ДНК при образовании нуклеосом.Шапероны есть во всех живых организмах, и механизм их действия, нековалентное присоединение к белкам и их «расплетение» с использованием энергии гидролиза АТФ также консервативен. Многоие шапероны являются белками теплового шока, то есть белками, экспрессия которых начинается в ответ на рост температуры или другие клеточные стрессы.[2]Тепло сильно влияет на фолдинг белка, а некоторые шапероны участвуют в исправлении потенциального вреда, который возникает из-за неправильного сворачивания белков. Другие шапероны участвуют в фолдинге только что созданных белков в тот момент, когда они «вытягиваются» из рибосомы. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие. Другие типы шаперонов участвуют в транспортировке веществ сквозь мембраны, например в митохондриях и эндоплазматическом ретикулуме у эукариот. Продолжают обнаруживаться новые функции шаперонов, например, участие в разрушении белка, деятельности бактериального адгезина и в реакциях на заболевания, связанные с агрегацией белков. Прио́ны (от англ. proteinaceous infectious particles — белковые заразные частицы) — особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда высших животных (т. н. «медленные инфекции»). Прионный белок, обладающий аномальной трёхмерной структурой, способен прямо катализировать структурное превращение гомологичного ему нормального клеточного белка в себе подобный (прионный), присоединяясь к белку-мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом α-спиралей белка в β-слои. Прионные заболевания человека. Наиболее известные прионные инфекции, связанные с поражением головного мозга:
болезнь Кройтцфельдта — Якоба (Creutzfeldt-Jakob disease);
фатальная семейная бессонница (Fatal Familial Insomnia);
болезнь Куру (Kuru), связана с ритуальным каннибализмом в некоторых странах Океании;
синдром Герстманна — Штройслера — Шейнкера (Gerstmann-Sträussler-Scheinker disease).
48. Впервые схема регуляция биосинтеза белка была предложена Жакобом и Моно в 1961г. Регулировать синтез Б. можно контролируя активность разных оперонов у бактерий. М-зм этой рег-ции выглядит так: В бакт. имеется группа белков – репрессоров -, кот контролируют транскрипцию разных оперонов. Участок ДНК, опред стр-ру репрессоров – ген-регулятор. Репрессоры связ. С оператором оперона и блокируют транскрипции опред мРНК=> возможность синтеза соотв. белка. В-ва, кот инактивируют репрессор – индукторы, а в-ва, переводящие его из неакт. сост. в актив. – корепрессоры. М-з индукции на примере регуляции транскрипции лактозного оперона. Л., поступ. в кл – индуктор. Она связ с репрессором лактозного оперона и переводит его в неакт форму, репрессор не мешает присоед РНК-полимеразы к промотору=>транскрипции. В отсутствии реп-ра нужны положительные регуляторы, помог-е РНК-полимеразе связаться с промотором и запустить транскрипцию. Это цАМФ. Она связ со спец белком – активатором катаболитного гена (БАК). цАМФ – БАК присоед к промотору рядом с местом связ-ния РНК-полимеразы и облегчает начало транскрипции. Рибосомы связ с мРНК и синтез 3 ферментных белка, необходимых для катаболизма лактозы. М-зм репрессии: расщепление ферм-ми лактозы снижает ее концентрацию и приводит к образ глюкозы. При распаде глюкозы образ метаболит, кот угнетает образ цАМФ из АТФ. => снижается связывание БАК – затрудняется присоед РНК-полимеразы к промотору. Репрессор стан активным, связ с оператором и блок транскрипцию. Синтез белков останавливается. В связи с наличием общих систем переноса при наследственных болезнях нарушен транспорт сразу нескольких аминокислот: при цистинурии - цистина, аргинина, лизина и орнитина; при хартнуповской болезни - моноаминомонокарбоновых аминокислот, особенно триптофана, фенилаланина и гистидина. Всасывание дипептидов при этом не страдает. В двенадцатиперстной и тощей кишках всасывание идет быстро, в подвздошной - медленно.
№49 Гниение б в кишечнике. В киш созд-ся оптимальные усл д/обр-ия ядовитых продуктов распада а/к-т (фенол, крезол, скатол), а также нетоксичных соед (спиртов, аминов, жирных к-т). Диаминокислоты, орнитин и лизин, подверг-ся проц декарбоксилирования с обр-ем протеиногенных аминов. Оба амина легко всас-ся в кр и выделяются с мочей. Обезвреж-ся уже в Кл слизистой оболочки киш по влиянием специфической диаминооксидаза.
Из ароматических а/к-т фенилаланила, тирозина и триптофана при декарбоксилировании обр-ся соотв-щие биогенные амины:фенилэтиламин, парагидроксифенилэтиламин (триптамин) и индокилэтиламин (триптамин). Помимо этого проц. микробные ф-ты киш-ка выз-ют постеп-ое разрушение боковых цепей циклич-их а/к-т (тирозина и триптофана), с обр-ем ядовитых продуктов обмена. После всас-ия эти продукты ч-з воротную вену попадают в печень, где они подверг-ся обезвреживанию путем хим-ого связ-ия с серной и глюкуроновой к-той с обр-ем нетоксичных к-т, кот выд-ся с мочей.
В печени сод-ся специфич-ие ф-ты – арилсульфатрансфераза и ЦДФ-глюкуронилтрансфераза, св-щие соотв-но перенос остатка серной к-ты из ее связ-ой ф. – 3 – фосфоаденозин – 5 – фосфосульфата (ФАФС) и остатка глюкуроновой к-ты также из ее связ-ой ф-уридиндифафосфаглюкуроновой к-ты (УДФГК) на любой из указ-ых выше Р.
Источниками ФАФС явл-ся промежуточные продукты обмена уриновых нуклеотидов и углеводов; не исключено возможное уч-ие р-5-ф, кот-ый обр-ся в проц пентозо-фосфатного пути ок-ия глюкозы. Предшеств-ми УДФГК в орг-ме явл-ся метаболиты глюкозы и УТФ. Индол (как и скатол) предварит-но подверг-ся ок-ию в индоксил (соотв-но скатоксил), кот-ый взаим-ет непоср-но с ф-ной р-ции с ФАФС. По кол-ву индикана в моче у чел-ка судят о скорости проц-ос гниения б в киш и о функц-ом сост печени.
№50 Первой стадией обновления белков является их гидролиз с помощью тканевых протеиназ, или катепсинов. Катепсины сосредоточены преимущественно в лизосомах. Белок, подвергающийся гидролизу, взаимодействует сначала с аппаратом Гольджи и эндоплазматическим ретикулумом клетки с образованием так называемых аутофагосом. Аутофагосомы атакуются первичными лизосомами, что приводит к образованию аутолизосом (или вторичных лизосом). Набор лизосомальных катепсинов быстро гидролизует белки, поглощенные этими органоидами. Протеиназы сока цитоплазмы дополняют действие катепсинов лизосом. Все катепсины делятся на экзопептидазы, гидро-лизирующие крайние пептидные связи с N- или С-конца полипептидной цепи, и эндопептидазы, гидролизующие внутренние пептидные связи. В зависимости от особенностей каталитических групп активного центра различают тиоловые катепсины (в каталитическом центре содержится цистен), аспарагиновые, или карбоксикатепсины (в каталитическом центре—аспарагиновая кислота), и сериновые (каталитический участок представлен серином). Тиоловые протеиназы тканей: Катепсин В – эндопептидаза. Во многих тканях; Катепсин N (или коллагенолитический фермент) - эндопептидаза.В лизосомах селезенки и плаценты.Катепсин Н — эндопептидаза и аминопептидаза. В печени. Катепсин L — эндопептидаза. Во всех тканях. Катепсин С(дипептидилдипептидаза I) - экзопептидаза. Катепсин S — эндопептидаза.В селезенки и лимфоузлах. Аспарагиновые протеиназы тканей: Катепсин D — эндопептидаза, активен в селезенке, почках, легких. Сериновые протеиназы тканей: Катепсин А(карбоксипептидаза А) — экзопептидаза,
№51 Наибольшее количество свободных аминокислот поступает из мышц и кишечника, причем до 50% составляет глутамин и аланин. Основное кол-во глутамина поставляют в кровь мышцы и мозг. Почки – основной источник серина и аланина. Головной мозг способен поглощать и окислять большие кол-ва аминокислот с разветвленной боковой цепью. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию – отщепление альфа-карбоксильной группы. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины). Амины часто являются биологически активными веществами. Они выполняют функции нейромедиаторов (серотони, дофамин), гормонов (норадренали, адренали), регуляторных факторов регуляторного действия (карнозин, гистамин). Для осущ-я биологической функции в нервных клетках требуется определенная концентрация биогенных аминов. Инактивация биогенных аминов происходит двумя путями: 1.Метилированием с участием S-аденазилматионином под действием метилтрансфераз. Т.о. могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гистамина и адреналина. 2.Окислением ферментами моноаминооксидазами с коферментом ФАД – таким путем чаще происходит инактивация норадреналина и серотонина.
№52 Наибольшее количество свободных аминокислот поступает из мышц и кишечника, причем до 50% составляет глутамин и аланин. Основное кол-во глутамина поставляют в кровь мышцы и мозг. Почки – основной источник серина и аланина. Головной мозг способен поглощать и окислять большие кол-ва аминокислот с разветвленной боковой цепью. Дезаминирование аминокислот – это реакция отщепления альфа-аминогруппы от аминокислоты, в результате чего образуется соответствующая альфа-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Существует несколько способов дезаминирования: окислительно, непрямое, неокислительное, внутримолекулярное. Окислительное дезаминирование наиболее активно идет на примере глутаминовой кислоты. Реакция идет в 2 этапа. В начале идет ферментативное дегидрирование глутамата образования альфа-эмино глутарата, затем – неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется альфа-кетоглутарат. Окислительное дезаминирование глутамата – обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении как восстановительное аминирование альфа-кетоглутарата. Непрямое дезаминирование – основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей альфа-кетакислоты. Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты трансаминазы функционируют как в процессах катабализма, так и биосинтеза аминокислот. Трансаминазы классический пример ферментов, катализирующих реакции, протекающие по механизму типа пинг-понг В таких реакциях первый продукт должен уйти из активного центра фермента до того, как 2-ой субстрат сможет к нему присоединиться. В норме в крови активность трансаминаз очень мала. При повреждение клеток соответствующего органа ферменты приходят в кровь, где активность их резко повышается. Аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) наиболее активны в клетках печени, сердца и, в меньшей степени скелетных мышц, их используют для диагностики болезни этих органов. Соотношение активностей АСТ/АЛТ называют коэффициент де Ритиса (норм 1,33). при инфаркте миокарда этот коэффициент резко возрастает, а при гепатитах увеличивается.
В 1975 г. нервной ткани были выделены 2 пентопептида: лейцин-энкефалин и метионин-энкефалин, обладающий способностью связываться с опиоидными рецепторами и действовать подобно морфину. Позднее в гипофизе были обнаружены и др. эндогенные опиаты – альфа-, бета-, гамма-эндорфины, являющиеся пептидами. Все эти вещества с опиатоподобным действием, включая ранее открытые энкифалины, получили общее групповое название – эндорфины. Они являются продуктами ограниченного протеолиза гормонов гипофиза. Считается, что в гипофизе образуется крупный прегормональный белок, из которого образуются бета-липотропин и кортикотропин. Ограниченный протеолиз бета-липотропина и кортикотропина приводит к образованию эндорфинов, пептидов обучения и памяти и альфа- и бета-меланотропинов. последние также содержат аминокислотную последовательность пептидов, облегчающих обучение и запоминание. Все нейропептиды являются медиаторами или модуляторами в синапсах, влияя на функцию нейронов. С эндорфинами связывают обезболивающие действия, в состоянии эйфории и отклонения психической деятельности вследствие нарушения их обмена при шизофрении. Эндорфины оказывают более сильное болеутоляющее действие, чем морфин.
№53. Пути обезвреживания аммиака. Аммиак обр-ся: 1) дезаминирование а/к-т; 2) ---- биогеннах аминов (гистамина, серотанина); 3) ---- пуриновых осований(гуанина и аденина); 4) ---- амидо а/к-т (аспарагина и глутомина); 5) распада пиримидиновых оснований (тимина, цитозина). АММИАК-оч токсичное соед, особенно д/нервных кл. При накоплении его возникает возбждение н.с. Мех-мы обезв-ния: 1)обр-ие мочевины; 2)восст-ое аминирование (трансаминир-ие); 3)обр-ие амидов а/к-т аспарагина и глутамина; 4) обр-ие аммонийных солей. Синтез мочевины. Представляет собой цикл-ий проц, в кот каталитическую рольиграет орнитин. Начальной р-цией этого цикла явл-ся синтез карбомоилофосфата. На обр-ие 1 мол мочевины расход-ся 3 мол АТФ. Мочевина-безвредное д/орг-ма соед. Главным местом ее обр-ия в орг-ме явл-ся печень, где есть все ф-ты мочевинообр-ия. В главном месте имеются все ф-ты синтеза мочевины, кроме карбомоилфосфатсинтетазы, поэтому в нем мочевина не обр-ся. Нарушение ф-ции печени ведет к уменьш мочевинообр-ия, и сод-ие мочевины в кр и выделение ее с мочой падает.
№54 Фениаланин-незаменимая аминокислота,т.к. в клетках животных не синтезируется её бензольное кольцо. Основное кол-во фенилаланина расходуется по 2-м путям: включается в белки и превращается в тирозин. Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина,т.к. высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, т.к. недостатка этой аминокислоты в клетках практически не бывает.Основной путь метаболизма фенилаланина начинается с его гидроксилирования в результате чего образуется тирозин. Эта реакция катализируется специфической монооксигеназой-фенилаланингидроксилазой,коферментом которой служит тетрагидробиоптерин. Тирозин-условно заменимая аминокислота, поскольку образуется из фенилаланина. Тирозин в разных тканях выступает предшественником катехоламины,тироксин,меланины. В печени происходит катаболизм тирозина до конечных продуктов. Обмен фенилаланина и тирозина связан со значительным кол-ом реакций гидроксилирования,которые катализируют оксигеназы. При образовании катехоламинов,которое происходит в нервной ткани и надпочечниках, и меланина в меланоцитах промежуточным продуктом служит диоксифенилаланин(ДОФА) Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами: тирозиназа,тирозингидроксилаза. Заболевание-фенилкетонурия. В печени здоровых людей небольшая часть фенилаланина превращается в фениллактат и фенилацетилглутамин. Этот путь катаболизма фенилаланина становится главным при нарушении основного пути-превращения в тирозин,катализируемого фенил-аланингидроксилазой. Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурия(ФКУ) Наиболее тяжёлые проявления ФКУ-нарушение умственного и физического развития,судорожный синдром. Некоторые нарушения катаболизма тирозина в печени приводит к тирозинемии и тирозинурии. Причиной заболевания является дефект фетмента фумарилацетонацетатгидролазы. Клинические проявления- диарея,рвота. Энзимопатия. В основе многих заболеваний лежат нарушения функционирования ферментов в клетке-энзомопатии. При первичных энзимопатиях дефектные ферменты наследуются по аутосомно-рецессивному типу. Гетерозиготы не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням,т.к. происходит нарушение определённых метаболических путей.Известно заболевание алкаптонурия. У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты. В присутствии кислорода эта кислота превращается в алкоптон. Алкаптон оседает в тканях,коже,суставах. Нарушение образования конечных продуктов и накопление субстратов предшественников- это связано с нарушением распада гликогена в печени и выходом из неё глюкозы вследствии дефекта фермента 6-фосфатфосфатазы.
№55 Переваривание углеводов начинается в ротовой полости с помощью альфа амилазы слюны и мальтазы. Альфа амилаза активируется ионами хлора и имеет рН=7,1, гидролизует альфа-1,4-гликозидные связи крахмала и гликогена пищи. После действия альфа аилазы слюны полисахариды расщепляются на альфалимитдекстрин, мальтазу и небольшое кол-во глюкозы. Дисахариды пищи, главными из которых являются сахароза, лактоза, трегалоза(дисахарид грибов) не расщепляются в полости рта. В желудке альфа амилаза инактивируется кислым содержимым желудка и переваривание углеводов прекращается. В кишечнике происходит полный гидролиз полисахаридов. Гидролиз углеводов в поджелудочной железе осуществляется панкреатической альфа амилазой и олиго1,6-глюкозидазой, а в кишечнике олигосахаридазами и дисахаридазами. Панкреатическая альфа амилаза гидролизует поступающий крахмал и гликоген до альфа лимитдекстринов и мальтозы. Олиго-1,6-глюкозидаза специфически разрывает альфа-1,6-гликозидные связи полисахаридов, при этом образуется мальтоза. Дисахариды гидролизуются не в полости, а в стенке кишечника, поэтому образующиеся моносахариды сразу же всасываются. Всасывание моносахаридов протекает 2-я путями: 1-облегченная диффузия с помощью белков транспортеров(при высокой концентрации моносахаридов) 2-активный транспорт с помощью ионов натрия(соответственно при высокой концентрации). Из клетки слизистой оболочки кишечника путем облегченной диффузии глюкоза попадает в кровь и более 1/2 остается в печени. Транспортеры глюкозы(ГЛЮТ) обнаружены во всех тканях. Описаны 5 типов: ГЛЮТ1-обеспечивает стабильный поток глюкозы в мозг; ГЛЮТ2-в клетках выделяет глюкозу в кровь, участвует в транспорте глюкозы в бета клетки поджелудочной железы; ГЛЮТ3-имеет большее сродство к глюкозе чем ГЛЮТ1 и тоже располагается в нервной ткани; ГЛЮТ4-главный переносчик глюкозы в клетки мышц и жировой ткани-инсулин зависимый; ГЛЮТ5-втонком кишечнике переносит фруктозу. Инсулин повышает проницаемость мембраны гепатоцитов, адипоцитов и мышечных волокон к глюкозе, а также делает возможным поступление глюкозы в эритроциты, НС и железы внут. и внеш. секреции. Остальные ткани являются и органы являются инсулиннезависимыми. К врожденным патологиям переваривания дисахаридов относятся: 1)хронические панкреатиты-уменьшается активность альфа амилазы в дуоденальном содержимом; 2)муковисцидоз-наследственное заболевание, для которого характерно системное поражение экзокринных желез-выработка очень густого секрета, закупорка и инфекционные поражения выводных протоков.
№56 Понятие «сахар крови» зависит от метода определения. Если в основе метода лежат редуцирующие св-ва глюкозы, то под «сахаром крови» понимают всю сумму редуцирующих вещ-в в крови и выражается в г/л (0,8-1,2). Если в основе метода лежит определение глюкозы по цветной реакции, то под «сахаром крови» понимается кол-во глюкозы в ней и выражается в моль/л (3,5-5,0). Сахар крови определяется натощак. Иногда сахар крови ниже нормы- гипогликемия, если выше нормы- гипергликемия. Если сахар крови превышает почечный порог (8-10ммоль/л.)- глюкозурия. Кол-во сахара в крови в норме, а в моче в избытке- почечный диабет. Исследования обмена углеводов методом сахарной нагрузки: 1 стакан сахара + 200мл. теплой воды, и втечение 3-х минут эта смесь должна быть съедена. Каждые 30 мин. У больного берут кровь и определяют кол-во сахара в течение 2-3 ч., строят сахарные кривые (рис. сахарной кривой). ВО показывает возрастание сахара в крови и называется гипергликемический отрезок. НО называется гипогликемическим отрезком. Если печень здорова, то максимум сахара будет через час, если больна, то раньше. Это зависит от кол-ва инсулина. Коэффициент Бодуэна- отношение сахара максимального к исходному. Коэффициент Рафальского- постгликемический коэффициент- отношение крови через два часа к исходному уровню.
№57 Гликогенез – синтез гликогена, он синтезируется в период пищеварения (через 1-2 часа после приема пищи), процесс требует затрат энергии. Глюкоза фосфорилируется при участие АТФ, затем глюкозо-6-фосфат превращается в глюкозо-1-фосфат, из которой образуется УДФ-глюкоза. Ее нуклеотидная часть помогает ферменту расположить глюкозу в полисахаридной цепи в нужном положении. Так как гликоген никогда не расщепляется в клетках полностью, синтез гликогена осуществляется путем удлинения уже имеющиеся молекулы полисахарида (праймер). К нему последовательно присоединяется молекула глюкозы, синтезируется полисахарид аналогичный праймеру. В состав праймера может входить белок гликогенин, по окончанию синтеза он остается включенным в гранулу гликогена. По мере синтеза гликогена многократно возрастает число ветвлений. Печень запасает глюкозу в виде гликогена для поддержания постоянной концентрации глюкозы в крови, мышечный гликоген высвобождает глюкозо-6-фосфат для окисления и использования энергии.
№58 Гликоген- депонированная форма глюкозы, высвобождает эту гексозу при участии гликогенфосфорилазы. Фермент катализирует фосфоролиз (расщепление с присоединением компонентов фосфорной к-ты) 1,4 гликозидной связи, с освобождением остатков глюкозы в виде глюкоза-1-фосфата, который под действием фосфоглюкомутазы превращается в Г-6-Ф. Его возможные пути превращения: 1) в мышцах, где нет Г-6-Фазы, по основному пути (аэробному или анаэробному). 2) в жировой ткани и других, где идут интенсивно восстановительные синтезы, по пентозофосфатному пути (для накопления НАДФ*Н2 ). 3) в печени, где много Г-6-Фазы, расщепляется на глюкозу и фосфат, глюкоза поступает в кровь. Т.о., гликоген выполн. ф-ию источника глюкозы крови или источника субстрата пентозофосфатный путь и аэробного превращения.
№59 Анаэробный гликолиз - процесс окисления глюкозы, в результате которого происходит расщепление глюкозы с образованием 2 молекул лактата. 1)Начинается с фосфорилирования глюкозы, катализирует гексокиназа. 2)изомеризация г-6-ф во ф-6-ф (фермент глюкозофосфатизомераза. 3)фосфорилирование ф-6-ф с образованием фруктозо-1,6-бисфосфата (фермент фосфофруктокиназа). 4)расщепление фруктозо-1,6-бисфосфата на глицеральдегид-3-фосфат и дигидроксиацетат (фермент фруктозо-1,6-бисфосфат-альдолаза). 5)взаимопревращение триозофосфатов (фермент триозофосфатизомераза) 6)окисление глицеральдегид-3-фосфата до 1.3-дифосфоглицерата (фермент глицеральдегид-3-фосфат-дегидрогеназа). 7)перенос фосфатной группы с 1.3-дифосфоглицерата на АДФ (ферм фосфоглицераткиназа) 8)изомеризация 3-фосфоглицерата в 2-фосфоглицерат (ферм фосфоглицерат-фосфомутаза) 9)дегидратация 2-фосфоглицерата с обр-м фосфоенолпирувата (ферм енолаза). 10)перенос фосфатной группы с фосфоенолпирувата на АДФ (ферм пируваткиназа) 11)восстановление пирувата до лактата (ферм лактатдегидрогеназа). Биологическая роль: Анаэробный гликолиз, несмотря на небольшой энергетический эффект, является основным источником энергии для скелетных мышц в начальном периоде интенсивной работы, то есть в условиях, когда снабжение кислородом ограничено. Кроме того, зрелые эритроциты извлекают энергию за счет анаэробного окисления глюкозы, потому что не имеют митохондрий. Энергетическая эффективность: На стадиях фосфорилирования глюкозы и фруктозы расходуется 2 АТФ. На двух стадиях гликолитического фосфорилирования образуется по 2 АТФ.=> чистый выход АТФ 2 молекулы на молекулу расщепленной глюкозы.
№60 Аэробный распад глюкозы включает реакции аэробного гликолиза и последующее окисление пирувата в реакциях катаболизма.1)Начинается с фосфорилирования глюкозы, катализирует гексокиназа. 2)изомеризация г-6-ф во ф-6-ф (фермент глюкозофосфатизомераза. 3)фосфорилирование ф-6-ф с образованием фруктозо-1,6-бисфосфата (фермент фосфофруктокиназа). 4)расщепление фруктозо-1,6-бисфосфата на глицеральдегид-3-фосфат и дигидроксиацетат (фермент фруктозо-1,6-бисфосфат-альдолаза). 5)взаимопревращение триозофосфатов (фермент триозофосфатизомераза) 6)окисление глицеральдегид-3-фосфата до 1.3-дифосфоглицерата (фермент глицеральдегид-3-фосфат-дегидрогеназа). 7)перенос фосфатной группы с 1.3-дифосфоглицерата на АДФ (ферм фосфоглицераткиназа) 8)изомеризация 3-фосфоглицерата в 2-фосфоглицерат (ферм фосфоглицерат-фосфомутаза) 9)дегидратация 2-фосфоглицерата с обр-м фосфоенолпирувата (ферм енолаза). 10)перенос фосфатной группы с фосфоенолпирувата на АДФ (ферм пируваткиназа) с образованием пирувата. Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс». 1)пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1)2)оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидроли-поилацетилтрансферазой (Е2) 3)Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением. 4)регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. 5)восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+. Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 коферментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), Энергетическая эффективность: 38 АТФ
№61 Пентозофосфатный путь является альтернативным путем окисления глюкозы. Этот процесс поставляет клеткам кофермент NADPH, использующийся как донор водорода в реакциях восстановления и гидроксилирования и обеспечивает клетки рибозой, которая участвует в синтезе нуклеотидов и нуклеиновых кислот. Пентозофосфатный путь не приводит к образованию АТФ. ферменты пентозофосфатного пути локализованы в цитозоле. В пентозофосфатном пути превращения глюкозы можно выделить 2 части: окислительный и неокислительный пути образования пентоз. Окислительный путь образования пентоз включает 2 реакции дегидрирования. Коферментом дегидрогеназ является НАДФ+, который восстанавливается в НАДФН. Пентозы образуются в результате реакции окислительного декарбоксилирования. Неокислительный путь образования пентоз включает реакции переноса 2 и 3 углеродных фрагментов с одной молекулы на другую. Этот путь служит для синтеза пентоз. Неокислительный путь образования пентоз обратим=> может служить для образования гексоз и пентоз. . Пентозофосфатный путь может функционировать в печени, жи ровой ткани, молочной железе, коре надпочечников эритроцитах, в органах, где активно протекают вое синтезы, например синтез липидов за один оборот цикла полностью распадается одна молекула глю козы. Суммарное уравнение пентозофосфатного цикла: 6глюкозо-6-фосфат + 12NADP+-> 12NADPH + 12Н+ 5глюкозо-6-фосфат + 6С02
Промежуточные продукты (фруктозо-6-фосфат, глицероальдегид-3-фосфат) могут включаться в пути аэробного и анаэробного окисления и служить источником энергии для синтеза АТФ.
№62 Гликоген представляет собой разветвленный полисахарид, мономером которого является глюкоза. Гликоген плохо растворим в воде и не влияет на осмотическое давление в клетке, поэтому в клетке депонируется гликоген, а не свободная глюкоза. Гликоген депонируется главным образом в печени и скелетных мышцах. Гликоген хранится в цитозоле клеток в форме гранул. С гранулами связаны и некоторые ферменты, участвующие в обмене гликогена, что облегчает им взаимодействие с субстратом. Синтез и распад гликогена протекают разными метаболическими путями Гликоген синтезируется в период пищеварения (1 -2 ч после приема углеводной пищи). Синтез гликогена требует энергии. При включении одного мономера в полисахаридную цепь протекают 2 реакции, сопряженные с расходованием АТФ и УTФ. Мобилизация гликогена происходит в основном в период между приемами пищи и ускоряется во время физической работы. Этот процесс происходит путем последовательного отщепления остатков глюкозы в виде глюкозо-1 -фосфата с помощью гликогенфосфорилазы. Необходимы еще 2 фермента, после действия которых глюкозный остаток освобождается в форме свободной глюкозы. Гликоген распадается до глюкозо-6-фосфата без затрат АТФ. Присутствие в печени глюкозо-6-фосфатазы обусловливает главную функцию гликогена печени - освобождение глюкозы в кровь в период между приемами пищи и использование ее другими органами.Через 10—18 ч после приема пищи запасы гликогена в печени значительно истощаются, а голодание в течение 24 ч приводит к полному его исчезновению. Функция мышечного гликогена заключается в высвобождении глюкозо-6-фосфата, используемого в самой мышце для окисления и получения энергии.
Переключение процессов синтеза и мобилизации гликогена в печени происходит при переходе состояния пищеварения в постабсорбтивный период или состояния покоя на режим мышечной работы. В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, в мышцах — инсулин и адреналин. Влияние этих гормонов на синтез и распад гликогена осуществляется путем изменения в противоположном направлении активности 2 ключевых фментов - гликогенсинтазы и гликогенфосфорилазы - с помощью их фосфорилирования и дефосфорилирования. Первичным сигналом для синтеза инсулина и глюкагона является изменение концентрации глюкозы в крови. В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается и решающим фактором является влияние глюкагона, который стимулирует распад гликогена в печени. В период пищеварения преобладающим является влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. Под влиянием инсулина происходит: а)стимуляция транспорта глюкозы в клетки мышечной ткани б)изменение активности ферментов путем фосфорилирования и дефосфорилирования. в)изменение количества некоторых ферментов. Адреналин имеет сходный с глюкагоном механизм действия на клетки печени. Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени. Тип рецепторов, с которыми взаимодействует адреналин, определяет, какая система будет использована.
Результатом действия адреналина в мышцах являются активация цАМФ-зависимых протеинкиназ и активация фосфорилазы путем ее фосфорилирования При переходе из постабсорбтивного состояния в абсорбтивное или по окончании мышечной работы прекращается секреция гормонов и вся система возвращается в исходное неактивное состояние. Аденилатциклаза и фосфолипаза С инактивируются. цАМФ разрушается фосфодиэстеразой, что вызывает переход всех внутриклеточных ферментов каскада в неактивную форму. Значение регуляции скоростей синтеза и распада гликогена в печени заключается в обеспечении постоянства концентрации глюкозы в крови. Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц, так и энергозатраты в состоянии покоя.
№ 63 Глюконеогенез – путь образования глюкозы denovo из низкомолекулярных метаболитов углеводного обмена цикла Кребса и соединений неуглеводной природы. По своей значимости вводит гораздо больший вклад в поддержание глюкозы в крови, чем гликогенолиз. Ключевые реакции гликонеогенеза: 1.Гексокеназная реакция обходится за счет глюкозо-6-фосфатазы. 2.Фосфофруктокеназная реакция обходится за счет фруктозо-1,6-дифосфатазы. 3.Пируваткеназная реакция протекает по двум путям. В первом пути ПВК под влиянием пируваткарбоксилазы превращается в ЩУК. А затем ФЭП-карбоксиназа превращает ЩУК в ФЭП. Во втором пути – при помощи малатфермента ПВК -> малат -> (малатдегидрогениза) ЩУК. ФЭП-карбоксикеназа превращает ЩУК в ФЭП в цепи гликонеогенеза, его недостаток приводит к смерти «в колыбели».
Цикл Кори(глюкозолактатный цикл)
Реакци
Источники субстрата гликонеогенеза.Мышечная ткань-главный источник субстратов гликонеогенеза. Существуют гликогенные аминокислоты(аланин,аспарагиновая кислота)
В ходе реакций переаминирования они превращаются в кетокислоты. По схеме глюкозоаланиновый цикл.
РЕАКЦИЯ
При длительном голодании белки мышечной ткани явл. важнейшим резервом гликонеогенеза. Эндокринная регуляция гликонеогенеза. Важнейшими активаторами гликонеогенеза – гормоны глюкокортикоиды. Они осуществляют эффект на уровне генома способствуя биосинтезу ферментов: ФЭП и карбоксикеназы и трансаминаз.
№64 Фруктоза и галактоза вовлекаются в гликолиз следующим образом. D-фруктоза фосфорилируется с помощью неспецифической гексокиназы с образованием фруктозо-6-фосфата. Фруктозо-6-фосфат является метаболитом гликолиза.Имеется и другой путь включения фруктозы в гликолиз. Она фосфорилируется с помощью фруктокиназы печени с образованием фруктозо-1-фосфата, который далее расщепляется фруктозо-1-фосфат-альдолазой на дигидроксиацетонфосфат и глицеральдегид. Галактоза сначала также фосфорилируется в печени с помощью галактокиназы:
D-Галактоза + АТФ ->D-Галактозо-1-фосфат + АДФ.
Далее галактозо-1-фосфат превращается в глюкозо-1 -фосфат. Для этой реакции изомеризации необходимы уридиндифосфатглюкоза (УДФ-глюкоза) и фермент галактозо-1-фосфат-уоидилтрансфераза:
Галактозо-1-фосфат+УДФ-глюкоза-—► УДФ-галактоза+Глюкозо-1-фосфат
Глюкозо-1-фосфат подключается к гликолизу, а УДФ- галактоза превращается в УДФ-глюкозу с помощью УДФ-глюкозоэпимеразы. Гала́ктоземи́я — наследственное заболевание, в основе которого лежит нарушение обмена веществ на пути преобразования галактозы в глюкозу (мутация структурного гена, ответственного за синтез фермента галактозо-1-фосфатуридилтрансферазы). Заболевание проявляется выраженной желтухой, увеличением печени, неврологической симптоматикой (судороги, нистагм (непроизвольное движение глазных яблок), гипотония мышц), рвотой; в дальнейшем обнаруживается отставание в физическом и нервно-психическом развитии, возникает катаракта. Фруктоземия состоит в непереносимости больным фруктозы вследствие недостаточности фермента фруктозо-1-фосфат-альдолазы в печени, почках, слизистой оболочке кишечника. Возникшая при этом фруктозурия сопровождается протеинурией и аминоацидурией. В крови накапливаются фруктоза и продукты ее обмена, обладающие токсическими свойствами.
№65 Имеются 3 клас
сификации липидов: А.структурная: 1.Липидные мономеры: высшие углеводы, высшие алифатические спирты, альдегиды, кетоны, изопреноиды и их производные, высшие аминокислоты (сфингозины), высшие полиолы, жирные кислоты. 2.Многокомпонентные липиды: 1)простые липиды: воски, простие диольные липиды, глицериды, стериды. 2)смешанные (сложные липиды): фосфолипиды, фосфоглицериды, диольные фосфатиды, сфингофосфатиды, гликолипиды. Б.по физико-химическим свойствам. Учитывает степень полярности: нейтральные и полярные. В.по физиологическому значению: резервные и структурные.
Глицериды или аглицерины – наиболее распространенная группа простых липидов. Являются эфирами жирных кислот и терхатамного спирта глицерина. Их называют нейтральными липидами. Глицериды делятся на моно-, ди-, три-глицерины, содержащие соответственно 1, 2 и 3 эфиросвязанных ацила (RCO-). Триацилглицерины определяют энергетическое значение пищевых липидов, которые составляют от 1/3 до 1/2 энергетической ценности пищи.
Источниками витамина F явл. растительные масла. Сут. потребность в нем взрослого человека 5-10 гр. Витамина F представляет собой сумму незаменимых ненасыщенных жирных кислот. Однако не все жирные кислоты обладают совойствами витамина F. Необходим для нормального роста и регенерации кожного эпителия, а так же для построения таких важных регуляторов, как простогландины. Поддерживает запасы витамина А и облегчает его действие на обмен веществ в тканях. Снижает содержание холестерина в крови. Очевидно, истинной не заменимой жирной кислотой явл. арахидоновая, которая одна устраняет все признаки недостаточности.
№66 Стероиды-это изопреноиды. Бльшинство стероидов являются спиртами, которые именуются стеринами или стеролами. Стерины животного происхождения-зоостерины, а растительные-фитостерины. Родоначальник этой группы-холестерин-важная составная часть клеточных мембран животных клеток .Суточная потребность в холестерине (1 г) может в принципе покрываться за счет биосинтеза. При смешанной диете примерно половина суточной нормы холестерина синтезируется в кишечнике, коже и главным образом в печени (примерно 50%), а остальной холестерин поступает с пищей. Значительная часть холестерина включена в липидный слой плазматических мембран. Большое количество холестерина расходуется в биосинтезе желчных кислот (см. с. 306), часть выделяется с желчью. Ежесуточно из организма выводится примерно 1 г холестерина. Очень небольшая часть холестерина используется для биосинтеза стероидных гормонов, включая кортизол, кортизон, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормона тестостерона, а по последним данным — играет важную роль в передаче нервных импульсов в головном мозге. В тканях он находится в свободном виде или в виде эфиров(стериды). Холестерином богаты ткани животных, в больших кол-ах содержится в нервной ткани, надпочечниках печени. Холестерин относят к стр-ным липидам. Стериды- это эфиры стеринов и жирных кислот. Чаще встречаются эфиры холестерина. Они содержатся в продуктах животного происхождение. Растительные стериды типа жирнокислотнык эфиров стигмастерина, эргостерина, бета-ситостерина составляют значительную часть общих стеринов растений.
Стероиды
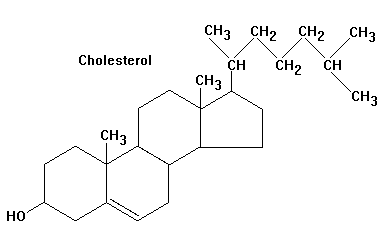
№66 Стероиды-это изопреноиды. Бльшинство стероидов являются спиртами, которые именуются стеринами или стеролами. Стерины животного происхождения-зоостерины, а растительные-фитостерины. Родоначальник этой группы-холестерин. Рисунок-холестерин, Seite 86. В тканях он находится в свободном виде или в виде эфиров(стериды). Холестерином богаты ткани животных, в больших кол-ах содержится в нервной ткани, надпочечниках печени. Холестерин относят к стр-ным липидам. Он входит в состав биологических мембран клеток. Стериды это эфиры стеринов и жирных кислот. Чаще встречаются эфиры холестерина. Они содержатся в продуктах животного происхождение. Растительные стериды типа жирнокислотнык эфиров стигмастерина, эргостерина, бета-ситостерина составляют значительную часть общих стеринов растений.
№67 Эйкозаноиды(Э)- биологически активные вещ-ва, синтезируемые большинством клеток из полиеновых жирных кислот, содержащих 20 углеродных атомов. Э, включающие в себя простогландины, тромбоксаны, лейкотриены- высокоактивные регуляторы клеточных функций. Э регулируют секрецию воды и натрия почками, влияют на образование тромбов. Главный субстрат для синтеза Э у человека арахидоновая кислота. Структура и номенклатура: 1-простогландины- обозначают символы(PG A, PG- простогландин, А-заместитель в пятичленном кольце в молекуле Э). Фермент, катализирующий 1-й этап синтеза простогландинов называется PG H2 синтазой и имеет 2 каталитических центра- циклооксигеназа и пероксидаза. Фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. 2-простациклины. Имеют 2 кольца- одно 5-и членное, а другое с участием атомов кислорода. Их подразделяют в зависимости от кол-ва двойных связей в радикале. 3-тромбоксаны- синтезируются в тромбоцитах, имеют 6-и членное кольцо, включающее атом кислорода. 4- лейкотриены- имеют три сопряженные двойные связи. Липоксигеназный путь синтеза, приводящий к образованию большого кол-ва разных Э, начинается с присоединения молекулы кислорода к одному из атомов углерода у двойной связи, с образованием гидроксипероксидов. Э: образуются в различных тканях и органах, действуют по аутокринному механизму. Механизм действия аспирина и других противовоспалительных препаратов нестероидного действия: аспирин- препарат, подавляющий основные признаки воспаления. Он уменьшает синтез медиаторов воспаления, следовательно уменьшает воспалительную реакцию. Использование производных Э в качестве лекарств: PG E1 и PG E2 подавляют секрецию соляной кислоты в желудке, блокируя гистаминовые рецепторы 2-го типа в клетках слизистой оболочки желудка. Эти лекарства, известные как Н2 блокаторы, ускоряют заживление язв желудка и 12 перстной кишки.
№67 Эйкозаноиды(Э)- биологически активные вещ-ва, синтезируемые большинством клеток из полиеновых жирных кислот, содержащих 20 углеродных атомов. Э, включающие в себя простогландины, тромбоксаны, лейкотриены- высокоактивные регуляторы клеточных функций. Э регулируют секрецию воды и натрия почками, влияют на образование тромбов. Главный субстрат для синтеза Э у человека арахидоновая кислота. Структура и номенклатура: 1-простогландины- обозначают символы(PG A, PG- простогландин, А-заместитель в пятичленном кольце в молекуле Э). Фермент, катализирующий 1-й этап синтеза простогландинов называется PG H2 синтазой и имеет 2 каталитических центра- циклооксигеназа и пероксидаза. Фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. 2-простациклины. Имеют 2 кольца- одно 5-и членное, а другое с участием атомов кислорода. Их подразделяют в зависимости от кол-ва двойных связей в радикале. 3-тромбоксаны- синтезируются в тромбоцитах, имеют 6-и членное кольцо, включающее атом кислорода. 4- лейкотриены- имеют три сопряженные двойные связи. Липоксигеназный путь синтеза, приводящий к образованию большого кол-ва разных Э, начинается с присоединения молекулы кислорода к одному из атомов углерода у двойной связи, с образованием гидроксипероксидов. Э: образуются в различных тканях и органах, действуют по аутокринному механизму. Механизм действия аспирина и других противовоспалительных препаратов нестероидного действия: аспирин- препарат, подавляющий основные признаки воспаления. Он уменьшает синтез медиаторов воспаления, следовательно уменьшает воспалительную реакцию. Использование производных Э в качестве лекарств: PG E1 и PG E2 подавляют секрецию соляной кислоты в желудке, блокируя гистаминовые рецепторы 2-го типа в клетках слизистой оболочки желудка. Эти лекарства, известные как Н2 блокаторы, ускоряют заживление язв желудка и 12 перстной кишки
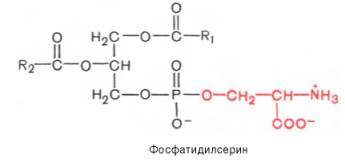
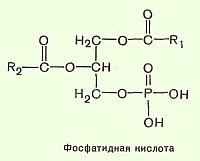
№68 Фосфоглицериды. В них одна из гидроксильных групп образует эфирную связь с фосфатом. Простейшие представители природных фосфоглицеридов – фосфотидная кислота. Радикалы жирных кислот находятся в транс-конфигурации. Гидроксилглицерин в положении один этерифицирован насыщенной жирной кислотой, в положении 2 ненасыщенной, а в положении 3 образуется фосфоэфирная связь с фосфорной кислотой. Все фосфоглицериды содержат остаток фосфатидной кислоты, соединенной со спиртовым остатком. Представители фосфоглицеридов: фосфатидные кислоты, этаноламинфосфатиды, холинфосфатиды, серинфосфатиды, инозидфосфатиды, кардиолипин и ацетальфосфатиды. Биологическая роль: они входят в состав клеточных мембран, образуя их липидную основу. Они явл. эмульгаторами для ацилглицеридов в кишечнике. Они стабилизируют растворимость холестерина в крови.