
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«РОСТОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
«ВОДОРОДОПОДОБНЫЙ АТОМ»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к решению задач по атомной физике
для студентов физического факультета
Ростов-на-Дону
2006
Методические указания разработаны кандидатом физико-математических наук, ассистентом кафедры нанотехнологии И.Н. Леонтьевым и кандидатом физико-математических наук, зав. кафедрой нанотехнологии Ю.И. Юзюком.
Ответственный редактор канд. физ.-мат. наук И.Н. Леонтьев
Компьютерный набор и верстка инженер Г.А. Колесников
Печатается в соответствии с решением кафедры общей физики физического факультета РГУ, протокол № 21 от 25 апреля 2006 г.
Основные формулы
1.Первый постулат Бора (условие стационарности орбит):
Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты (стационарные состояния), для которых момент импульса электрона удовлетворяет следующему условию:
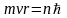 ,
,
где m–масса
электрона, v
– скорость электрона на орбите радиуса
r,
n
– номер орбиты (главное квантовое число
n=1,2,3..),
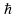 –
постоянная Планка.
–
постоянная Планка.
Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн.
2. Второй постулат Бора
При переходе атома
из стационарного состояния с большей
энергией Ei
в стационарное состояние с меньшей
энергией Ej
происходит излучение кванта света
(фотона) с энергией
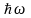 :
:
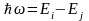 ,
,
где – циклическая частота излучения при переходе с i-ой на j-ю орбиту (i>j), Ei и Ej - энергии электрона на этих орбитах.
Такое же соотношение выполняется и в случае поглощения фотона, когда атом переходитс низшего энергетического уровня Ej на более высокий уровень Ei.
3. Обобщенная формула Бальмера:
Излучение невзаимодействующих друг с другом атомов состоит из отдельных спектральных линий, причем они расположены не беспорядочно, а объединяются в группы или, как их называют, серии линий. Было обнаружено, что частоты волн в различных сериях, описываются следующей формулой – формулой Бальмера:
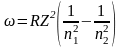 где
где
 ,
,
где – циклическая частота перехода между состояниями с квантовыми числами n1 и n2, R – постоянная Ридберга, Z – заряд ядра (в единицах е), k = 1/4o, o – диэлектрическая постоянная, ( n1=1 – серия Лаймана, n1 =2 – серия Бальмера, n1=3 – серия Пашена, n1=4 – серия Брэкета, n1=5 – серия Пфунда, n1=6 – серия Хэмфри).
Серия Лаймана находится в ультрафиолетовой части спектра, видимой части спектра принадлежит серия Бальмера, остальные серии лежат в инфракрасной области.
Задача №1

В
классической электродинамике показывается,
что электрон, движущийся с ускорением
a,
излучает в единицу времени энергию ,
где k=1/40.
Оценить на основе классических
представлений «время жизни» атома,
считая, что полное ускорение совпадает
с центростремительным.
,
где k=1/40.
Оценить на основе классических
представлений «время жизни» атома,
считая, что полное ускорение совпадает
с центростремительным.
Для простоты будем считать, что электрон в любой момент времени, до падения на ядро, движется равномерно, по круговой орбите. Причем будем считать, что в момент времени t=0 электрон движется по первой боровской орбите, т.е. r1=0.5310-10м. Тогда согласно 2-му Закону Ньютона
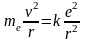
 .
.
Тогда кинетическая энергия электрона K и ускорение а будут равны
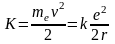 ,
,
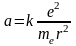 (1)
(1)
и полная энергия электрона в поле ядра
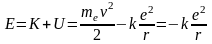 .
(2)
.
(2)
Очевидно, что энергия, которая будет излучаться за время dt ,будет равна убыли полной энергии электрона dE, тогда
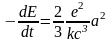 или
или
 .
.
Подставляя в формулу (3), выражения для полной энергии Е (2) и ускорения а (1), получим
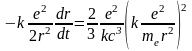 . (3)
. (3)
Разделяя переменные, получим
 .
.
Проинтегрируем это уравнение: левую часть по r от r1 до 0, а правую по t от 0 до .
 .
.
В результате получим
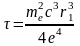 .
.
Подставляя в последнее выражение численные значения, получим = 1.310-11с.
Задача №2
Частица массы m движется по круговой орбите в центрально симметричном потенциальном поле U=r2/2 . Найти, используя условия квантования Бора, разрешенные радиусы орбит и уровни энергии частицы.
Если потенциальное поле обладает сферической симметрией, то
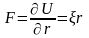 . (4)
. (4)
Исходя из второго закона Ньютона
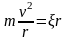 . (5)
. (5)
Согласно правилу квантования Бора
, где n = 1,2,3… .. (6)
Выражая из (6) скорость частицы v и подставляя в (5) найдем возможные значения r:
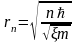 .
.
Возможные значения полной энергии будут описываться следующим уравнением:
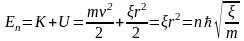 .
.
Задача №3
Определить для водородоподобного иона радиус n-ой боровской орбиты и скорость электрона на ней. Вычислить эти величины для первой боровской орбиты атома водорода и ионов Не+ и Li++.
Поскольку электрон двигается по круговой орбите, то
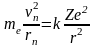 ,
,
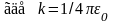 ,
(7)
,
(7)
где rn – радиус n – ой орбиты, vn – скорость электрона на n – ой орбите.
Согласно правилу квантования Бора
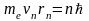 .
(8)
.
(8)
Откуда
 .
Подставляя выражение, полученное для
vn
в (7), получим
.
Подставляя выражение, полученное для
vn
в (7), получим
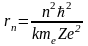 .
(9)
.
(9)
Подставив (9) в (8), получим выражение для vn
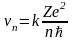 .
.
Значения радиуса первой боровской орбиты r1 и скорости электрона на ней v1, для атомов водорода и ионов Не+ и Li++, приведены в таблице 1.
Таблица 1.
-
v1, 106 м/с
r1, 10-10м
Н
2.19
0.529
He+
4.37
0.265
Li++
6.56
0.176
Задача №4
Интерпретировать квантовые условия Бора на основе волновых представлений: показать, что стационарным боровским орбитам соответствует целое число дебройлевских волн. Найти длину волны электрона на n-ой орбите.
На стационарной боровской орбите будет укладываться целое число дебройлевских волн, если
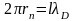 где l
= 1,2,3. (10)
где l
= 1,2,3. (10)
По определению длина волны де Бройля равна (в случае если электрон движется на n - ой боровской орбите)
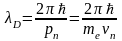 ,
,
где
pn
– импульс электрона на n
- ой боровской
орбите,
 - скорость электрона на n
- ой боровской орбите (см. задачу №2 ).
Отсюда
- скорость электрона на n
- ой боровской орбите (см. задачу №2 ).
Отсюда
 (11)
(11)
Подставим полученное выражение для D в (10) и, учтя, что радиус на n - ой боровской орбиты равен
,
получим
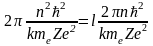 .
.
Откуда l = n. Т.к. n целое положительное число, то мы можем сделать вывод, что на любой стационарной боровской орбите любого водородоподобного иона укладывается целое число дебройлевских длин волн.
Задача №5
Какова величина тока, соответствующего движению электрона на n-ой орбите атома водорода (n=1)?
По определению сила эквивалентного кругового тока равна:
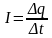 .
.
При движении электрона по орбите за время равное одному периоду Т переносится заряд е (е – заряд электрона). Отсюда
 .
.
Период обращения электрона на n - ой орбите равен
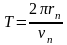 ,
,
где
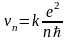 – скорость электрона на n
– ой орбите
(см. задачу№2);
– скорость электрона на n
– ой орбите
(см. задачу№2);
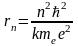 – радиус n
- ой орбиты.
– радиус n
- ой орбиты.
Отсюда
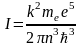 .
.
Подставляя числовые значения и произведя вычисления для первой боровской орбиты (n = 1) получаем I = 1,0610-3 А.
Задача №6
Электрон в атоме водорода движется вокруг ядра по круговой орбите некоторого радиуса. Найти отношение магнитного момента pm эквивалентного кругового тока и к моменту импульса L орбитального движения электрона.
Магнитный момент pm эквивалентного кругового тока и момент импульса L электрона, двигающегося по n - ой орбите, по определению равны

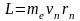 ,
,
где
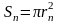 – площадь контура, ограниченного n
- ой орбитой,
– площадь контура, ограниченного n
- ой орбитой,
 – сила эквивалентного
кругового тока,
vn
– скорость электрона на n
- ой орбите,
rn
– радиус n
- ой орбиты.
Отсюда
– сила эквивалентного
кругового тока,
vn
– скорость электрона на n
- ой орбите,
rn
– радиус n
- ой орбиты.
Отсюда
 .
.
Задача №7
Найти для водородоподобных ионов кинетическую энергию К электрона и его энергию связи Есв в основном состоянии, а также потенциал ионизации i. Вычислить эти величины для атома водорода и ионов Не+ и Li++.
В предыдущей задаче было найдено значение скорости электрона на n - ой орбите. Оно имеет вид:
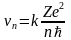 ,
,
Выражение для кинетической энергии электрона, находящегося на n - ой боровской орбите будет иметь следующий вид:
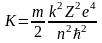 .
.
А поскольку k2me4/2ћ3 = R - постоянная Ридберга, выражение для кинетической энергии электрона на n - ой боровской орбите примет вид

Полная энергия электрона (находящегося на n - ом уровне) в кулоновском поле ядра равна
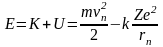
Используя выражения для vn и rn, полученные в задаче №3, получаем
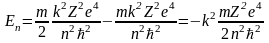
Состояние атома с наименьшей энергией (n = 1) называют основным. Эта энергия (по модулю) является энергией связи электрона в основном состоянии Есв = Е1. Именно эту энергию надо сообщить электрону в основном состоянии (n = 1), чтобы удалить его из атома. Таким образом, потенциал ионизации i будет определяться следующим выражением:
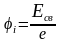 .
.
Значения
кинетической энергии K,
энергии связи Есв
и потенциал ионизации
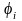 для атома водорода и ионов He+
и Li++
приведены в таблице 2.
для атома водорода и ионов He+
и Li++
приведены в таблице 2.
Таблица 2
|
K, эВ |
Есв, эВ |
i, В |
Н |
13.6 |
13.6 |
13.6 |
He+ |
54.5 |
54.5 |
54.5 |
Li++ |
122.5 |
122.5 |
122.5 |
Задача №8
Определить первый потенциал возбуждения φ1 и длину волны резонансной линии (головной линии серии Лаймана) для атома водорода и ионов He+ и Li++.
Первый потенциал возбуждения φ1 соответствует переходу электрона из основного состояния n1 = 1 на уровень с n2 = 2.
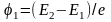
Поскольку
 ,
,
то
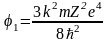 .
.
Учитывая, что
,
выражение для первого потенциала возбуждения приобретает следующий вид
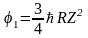 .
.
Для нахождения длины волны в головной линии серии Лаймана воспользуемся обобщенной формулой Бальмера
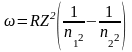 .
.
Поскольку в нашем случае n1 = 1, n2 = 2, то
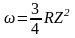
и, используя связь частоты с длиной волны, окончательно получим
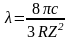 .
.
Значения первого потенциала возбуждения φ1 и длины волны λ головной линии серии Лаймана для атома водорода и ионов He+ и Li++ представлены в таблице 3.
Таблица 3
-
, нм
1, В
Н
121.5
10.2
He+
30.4
40.8
Li++
13.5
91.5
Задача №8
Вычислить длину волны спектральной линии атомарного водорода, частота которой равна разности частот следующих двух линий серии Лаймана: 1=102.6 нм, 2=97.27 нм. Какой серии принадлежит эта линия?
Для вычисления длины волны некоторой спектральной линии атомарного водорода (Z = 1) воспользуемся формулой Бальмера:
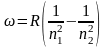 (12)
(12)
или с учетом связи частоты и длины волны получим:
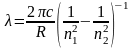 . (13)
. (13)
Для линий серии Лаймана (n = 1) это уравнение будет иметь вид:
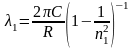 ,
,
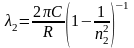 ,
,
отсюда
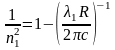 ,
,
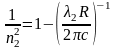 ,
,
подставляя в (13) получим
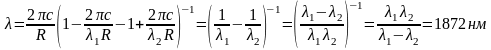 .
.
Рассчитав значение n1 определим к какой серии принадлежит эта линия
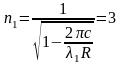 ,
,
т.е линия принадлежит серии Пашена.
Задача №9
У какого водородоподобного иона разность длин волн головных серий Бальмера и Лаймана равна 59,3 нм?
Для определения типа водородоподобного иона воспользуемся обобщенной формулой Бальмера
. (14)
Поскольку для головной линии серии Бальмера n1 = 2, n2 = 3, а для головной линии серии Лаймана n1 = 1, n2 = 2. То (14) для головной линии серии Бальмера примет вид:
 ,
,
а для головной линии серии Лаймана
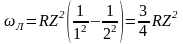 .
.
Учтя связь частоты с длиной волны, получим
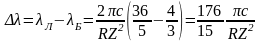 .
.
Откуда
 .
.
Что соответствует иону Li++.
Задача №10
В спектре некоторых водородоподобных ионов длина волны третьей линии серии Бальмера равно 108,5 нм. Найти энергию связи электрона в основном состоянии этих ионов.
Запишем обобщенную формулу Бальмера
. (15)
Для третьей линии серии Бальмера n1 = 2, n2 = 5, тогда, с учетом того что
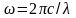 ,
,
выражение (15) примет следующий вид:
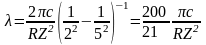 . (16)
. (16)
Поскольку (см. задачу №7)
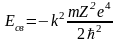 и
,
и
,
то
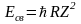 .
.
Тогда с учетом (16) получим
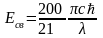 =54.5
эВ.
=54.5
эВ.
Это энергия связи электрона в основном состоянии иона He+.
Задача №11
Учитывая движение ядра атома водорода и боровское условие квантования, найти: 1) возможные расстояния между электроном и ядром; 2) возможные значения полной кинетической энергии; 3) энергию связи электрона; 4) на сколько процентов отличается энергия связи и постоянная Ридберга, полученные без учета движения ядра, от соответствующих уточненных значений этих величин.
Пусть R и r – расстояния, соответственно от ядра и электрона до общего центра вращения. Тогда согласно 2-му Закону Ньютона
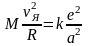
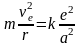 , (17)
, (17)
, М и m – массы ядра и электрона, соответственно, vЯ и vе – их скорости, а – расстояние между ядром и электроном, равное R + r.
Согласно правилу квантования Бора
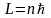 ,
где n
= 1,2,3…,
,
где n
= 1,2,3…,
где L – момент импульса, равный в данном случае,
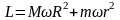 ,
,
тогда
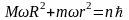 . (18)
. (18)
Используя связь линейной и угловой скорости
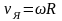
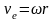 ,
,
перепишем (17) в следующем виде
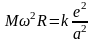
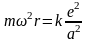 (19)
(19)
или
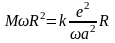
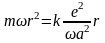
Подставляя, полученные выражения в (18), получим
 .
.
Отсюда
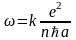 .
.
Подставив найденное выражение для в (19) найдем выражения для R и r
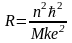 ,
,
 .
.
Отсюда
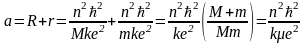 ,
,
где
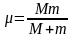 – приведенная
масса.
– приведенная
масса.
Полная кинетическая энергия атома водорода в данном случае будет складываться из кинетической энергии вращательного движения ядра КЯ и электрона Ке
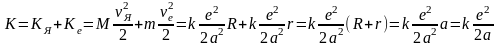 .
.
Подставляя сюда выражение, найденное выше для а, получим
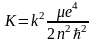 .
.
Полная энергия системы равна сумме кинетической и потенциальной энергий
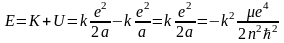 .
.
Тогда выражение для энергии связи (n = 1) будет иметь следующий вид:
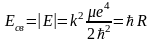 ,
,
где
 – уточненное выражение для постоянной
Ридберга.
– уточненное выражение для постоянной
Ридберга.
Сравнивая полученные выражения для постоянной Ридберга R и энергии связи Есв с аналогичными выражениями, полученными нами ранее, но без учета движения ядра (т.е M = ), можно видеть, что
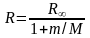
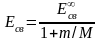 .
.
Подставляя численные значения, оказывается, что разница составляет 0,055%. Несмотря на столь малое различие, его удается зафиксировать с помощью современных спектральных приборов.
