
- •Введение
- •Строение атома и периодический закон д. И. Менделеева
- •Контрольные вопросы
- •Варианты контрольных заданий
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Вариант 31
- •Вариант 32
- •Вариант 33
- •Вариант 34
- •Вариант 35
- •Содержание
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Красноярский государственный технический университет
ОБЩАЯ ХИМИЯ
СТРОЕНИЕ АТОМА.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Д. И. МЕНДЕЛЕЕВА
Тестовый опрос
Красноярск 2002
УДК 546/547(07)
Г 52
Строение атома. периодическая система элементов Д. И. Менделеева:
Тестовый опрос для студентов дистанционной формы обуче6ния всех специальностей / Сост. Н. Я. Гладкова, Е. В. Грачева, Л. В. Фоменко. Красноярск:
ИПЦ КГТУ, 2002. 45 с.
Печатается по решению
Редакционно-издательского совета университета
© КГТУ, 2002
Введение
В методических указаниях изложен материал, способствующий наиболее эффективной самостоятельной работе студентов, а также максимальному ускорению решения задач и проверке усвоения раздела курса общей химии.
При подготовке к семинарским занятиям студент знакомится с вариантами контрольных задач и прорабатывает теоретический материал в объеме программы. Для контроля каждый студент получает задание с десятью вопросами, восемь из которых имеют по четыре ответа на каждый вопрос, это позволяет использовать выборочный метод ввода ответов. Каждый из восьми вопросов охватывает только часть темы и позволяет выявить умение студентов использовать теоретический материал по строению атома при рассмотрении Периодической системы Д. И. Менделеева, при этом изучают свойства девяти различных элементов.
Поскольку метод выборочного ответа не приучает студентов мыслить логически, введены две теоретические задачи, одна из которых требует логического мышления при составлении и написании электронной формулы элементов, а вторая связана с теоретическим рассмотрением одного из разделов курса.
Предлагаемые варианты ответов позволяют студентам с помощью логического обоснования выбрать правильное решение задачи. Задачи направлены на углубленное понимание структуры Периодической системы Д. И. Менделеева на основе теории строения атома. Все вопросы объединены в две-три логические линии, поэтому в процессе поиска правильного ответа студенты используют ранее приобретенные знания и учатся правильно оперировать ими. Такой подход способствует формированию мировоззрения о строении атома и структуре Периодической системы элементов как единого целого.
При подготовке к семинару по теме “Строение атома и Периодическая система элементов Д. И. Менделеева” рассматривают варианты всех контрольных задач. Перед началом работы каждому студенту называют вариант. При работе над вариантами задач тестируемый должен иметь индивидуальную схему Периодической системы. При правильной подготовке и полном усвоении теоретического материала студенты в течение 20-25 минут выполняют задачи, в оставшееся время проводится устная беседа по теме “Строение атома и Периодическая система элементов Д. И. Менделеева”.
В ответах на вопросы выявляются последовательность и логичность изложения материала. Правильные, логичные и обоснованные ответы на поставленные вопросы оцениваются на “5” и студент освобождается от сдачи материала по данной теме на экзамене.
Строение атома и периодический закон д. И. Менделеева
Атомы состоят из атомного ядра и электронных оболочек. Атомное ядро включает протоны нейтроны с массовыми числами, равными единице. Массовое число ядра равно сумме протонов и нейтронов. Нейтроны электронейтральны, поэтому заряд ядра определяется только числом протонов. Так как химические свойства элементов зависят только от заряда ядра, то атомы с одинаковыми химическими свойствами и различными массами ядер называют изотопами. Существующие в природе элементы являются смесью изотопов, а атомная масса их выражает массу изотопов. Поэтому массовые числа атомов имеют нецелочисленные значения. Если один из изотопов наиболее распространен в природе, то атомная масса элемента примерно равна массе этого изотопа.
Число протонов в атоме равно числу электронов и равно порядковому номеру элемента.
Состояние электрона в атоме характеризуется четырьмя квантовыми числами. Главное квантовое число “n” определяет энергию уровня, на котором находится электрон и принимает целочисленные значения: 1, 2, 3, и т.д.
Орбитальное квантовое число l определяет форму электронного облака и принимает значения от 0 до (n-1). Так при n=4 орбитальное квантовое число может принимать значения 0, 1, 2, 3, а электроны с этими l называют s-, p-, d-, f -электронами.
Магнитное квантовое число ml определяет наклон электронного облака относительно магнитной оси атома в слабых магнитных или электромагнитных полях. Оно изменяется от -l до +l. Так при l=0, ml=0, а при l=4, ml может принимать значения -4, -3, -2, -1, 0, +1, +2, +3, +4.
Спиновое квантовое число ms характеризуется собственным механическим моментом электрона и принимает только два значения +1/2 и -1/2.
Заполнение энергетических уровней электронами происходит в порядке возрастания энергии уровней и подуровней в соответствии с правилами Клечковского. Поскольку сумма двух квантовых чисел (n+l) определяет энергию электрона в атоме, то их и используют для указания энергетического состояния электрона. Сначала заполняется уровень 1s, затем 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Энергетические
уровни обозначаются цифрами 1, 2, 3 и т.д.,
рядом записываются буквами s, p, d,
f-подуровни, на которых находятся
электроны. Цифровой индекс в степени
буквенного обозначения показывает
количество электронов на данном
подуровне. Это основа принципа написания
структуры атома с помощью электронных
формул. Например, структуру атома хлора
можно изобразить с помощью электронной
формулы:
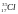 1s2,
2s2,
2p6,
3s2,
3p5,
где показан символ элемента, его
порядковый номер, относительная атомная
масса, распределение электронов по
уровням и подуровням. Валентные электроны
подчеркнуты.
1s2,
2s2,
2p6,
3s2,
3p5,
где показан символ элемента, его
порядковый номер, относительная атомная
масса, распределение электронов по
уровням и подуровням. Валентные электроны
подчеркнуты.
Для определения состояния электрона в многоэлектронных атомах важное значение имеет запрет Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Каждая атомная орбиталь, характеризующаяся определенными значениями n, l, ml квантовых чисел, может быть занята только двумя электронами, спиновые характеристики которых имеют противоположные значения. Принцип Паули позволяет определить максимальное число электронов на различных энергетических уровнях и подуровнях атома. Два электрона, находящиеся на одной орбитали, называются спаренными, в отличие от одиночных электронов (неспаренных).
Если электроны заполняют подуровни с одинаковой энергией, то по правилу Гунда они распределяются так, чтобы число неспаренных электронов было максимально. Устойчивому состоянию атома способствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. При этом заполненный наполовину или полностью заполненный подуровень имеет повышенную устойчивость, но если недостает одного-двух электронов для такого типа заполнения, то обычно этот электрон переходит с другого энергетического уровня. Это явление названо “проскок” или “провал” электрона.
Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869г. впервые сформулировал Периодический закон: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Данные о строении ядра и о распределении электронов в атомах позволяют по-новому рассмотреть периодический закон и Периодическую систему элементов. На базе современных представлений периодический закон формулируется так: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Из рассмотрения электронных конфигураций атомов наглядно проявляется периодичность свойств элементов.
По мере роста заряда ядра периодически повторяются сходные электронные структуры элементов, а следовательно, и повторяются их свойства, зависящие от строения электронной оболочки атомов.
Элементы, в зависимости от того, какой подуровень в атоме заполняется в последнюю очередь (s-, p-, d-, f-подуровень), делятся на s-, p-, d-, и f-элементы.
Химические элементы по строению электронных оболочек невозбужденных атомов объединяются в естественные совокупности, которые представлены в Периодической системе горизонтальными и вертикальными рядами – периодами и группами.
По числу энергетических уровней в Периодической системе элементы подразделяются на семь периодов, три из которых (первый, второй и третий) малые, а остальные – большие периоды (седьмой период незавершен). Различная длина периодов объясняется различием в последовательности заполнения электронных уровней (внешних и более близких к ядру). Первый период состоит из 2-х элементов (два s- элемента). Второй и третий периоды содержат по 8 элементов (два s- и шесть р-элементов). Четвертый и пятый периоды содержат по 18 элементов (два s-, десять d- и шесть р-элементов). Шестой период содержит 32 элемента (шесть s-, четырнадцать f-, десять d- и шесть p-элементов). В седьмом периоде имеются два s-элемента, четырнадцать f- и десять d-элементов, это элементы 106-110. В противоположность предыдущему периоду седьмой период не завершен.
d- и f-элементы данного периода объединяются в семейства. В четвертом, пятом, шестом периодах эти семейства состоят из десяти 3d- (Sс – Zn), 4d- (Y – Cd) и 5d- (La, Hf – Нg) элементов. В шестом, седьмом периодах это семейства – из четырнадцати 4f - элементов-лантаноидов (Ce – Lu) и 5f-элементов (Th – Lr).
Элементы Периодической системы подразделяются на восемь групп. Это соответствует максимальному числу электронов на внешнем уровне их невозбужденных атомов.
Элементы групп подразделяются на подгруппы: s- и р-элементы составляют главную подгруппу или подгруппу А, d- и f-элементы – побочные или подгруппу В.
Свойства элементов, определяемые электронной оболочкой атома, закономерно изменяются по периодам и группам Периодической системы. Химическая природа элемента обусловлена способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации называется количество энергии, необходимое для отрыва электрона от невозбужденного атома. Наименьшей энергией ионизации обладают s-элементы I группы, наибольшей – s- и p-элементы VIII группы.
Сродством к электрону называется энергетический эффект присоединения электрона к нейтральному атому с превращением его в отрицательный ион. Наибольшим сродством к электрону обладают р-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar).
Электроотрицательность – это способность атома оттягивать на себя электронную плотность (по сравнению с атомами других элементов в соединении). В периодах с увеличением порядкового номера элемента наблюдается общая тенденция роста электроотрицательности элементов, а в группах – ее падение. Наименьшая электроотрицательность у s-элементов I группы, а наибольшая – у р-элементов VII группы.
