- •Глава 8
- •8.1. Кристаллические и аморфные тела
- •8.2. Кристаллические структуры
- •8.3. Дефекты кристаллов
- •8.4. Механические свойства твердых тел
- •8.4.1. Деформация твердых тел
- •8.4.2. Прочность твердых тел
- •8.4.3. Распространение упругих волн в твердых телах
- •8.5. Тепловые свойства твердых тел
- •8.5.1. Тепловое расширение твердых тел
- •8.5.2. Теплоемкость твердых тел
- •8.6. Плавление и кристаллизация
- •8.7. Тройная точка. Полиморфные превращения
8.6. Плавление и кристаллизация
Если твердое кристаллическое тело нагреть, то при некоторой температуре оно переходит в жидкое состояние. Этот фазовый переход первого рода называется плавлением твердых тел. Обратный переход вещества из жидкого состояния в твердое кристаллическое состояние называется кристаллизацией. При плавлении происходит разрушение кристаллической решетки. Свойства вещества при этом меняются скачкообразно. При плавлении теплота поглощается, а при кристаллизации – выделяется. Причиной плавления или кристаллизации, как и причиной любых фазовых превращений, является изменение стабильности фаз в зависимости от внешних воздействий. Например, стабильная в определенной области температур фаза становится нестабильной при повышении (плавление) или понижении (кристаллизация) температуры.
Опыт показывает, что когда при нагревании твердого тела его температура достигает температуры плавления данного вещества, дальнейший подвод тепла не приводит к повышению температуры, пока тело не расплавится. Все тепло, сообщаемое при этом телу, идет только на работу по разрушению кристаллической решетки; оно называется теплотой плавления. Переход вещества из кристаллического состояния в жидкое происходит при вполне определенных условиях, характеризуемых равновесными значениями давления и температуры. Равновесию этих двух фаз на диаграмме рТ соответствует кривая, называемая кривой плавления. Ее ход, как и в случае кривой равновесия жидкость-пар, определяется уравнением Клапейрона – Клаузиуса (7.7). Перепишем его в виде
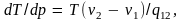
где
v1
и v2
– удельные (в расчете на одну частицу)
объемы вещества соответственно в
твердом и жидком состояниях,
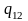 – удельная теплота плавления
– удельная теплота плавления
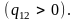 В большинстве случаев плавление
сопровождается увеличением объема,
т.е. v2
– v1
> 0, и
соответственно
В большинстве случаев плавление
сопровождается увеличением объема,
т.е. v2
– v1
> 0, и
соответственно
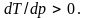 Поэтому с увеличением давления температура
плавления повышается. Кривая плавления
(рис.8.10) в этом случае аналогична
кривой равновесия жидкость-пар (рис.
7.7), но идет значительно круче и не имеет
конца. У некоторых веществ (вода, чугун,
висмут) плавление сопровождается
уменьшением объема. В этом случае
Поэтому с увеличением давления температура
плавления повышается. Кривая плавления
(рис.8.10) в этом случае аналогична
кривой равновесия жидкость-пар (рис.
7.7), но идет значительно круче и не имеет
конца. У некоторых веществ (вода, чугун,
висмут) плавление сопровождается
уменьшением объема. В этом случае
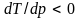 и соответственно температура плавления
понижается при увеличении давления.
и соответственно температура плавления
понижается при увеличении давления.
При
температуре фазового перехода
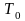 в равновесии находятся две фазы: расплав
и кристалл. При переохлаждении на
величину
в равновесии находятся две фазы: расплав
и кристалл. При переохлаждении на
величину
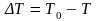 расплав
(фаза 1) становится метастабильным по
отношению к устойчивой фазе 2 – кристаллу.
Для начала спонтанного процесса
кристаллизации необходимо возникновение
кристаллического зародыша (центра
кристаллизации). Энерге-
расплав
(фаза 1) становится метастабильным по
отношению к устойчивой фазе 2 – кристаллу.
Для начала спонтанного процесса
кристаллизации необходимо возникновение
кристаллического зародыша (центра
кристаллизации). Энерге-
Рис. 8.10 |
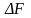 при
образовании зародыша будет
при
образовании зародыша будет
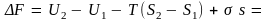
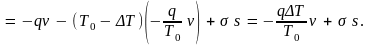
Удельная теплота плавления здесь относится к единице объема кристалла. Считая, что зародыш имеет сферическую форму радиуса r, перепишем это равенство в виде
 (8.4)
(8.4)
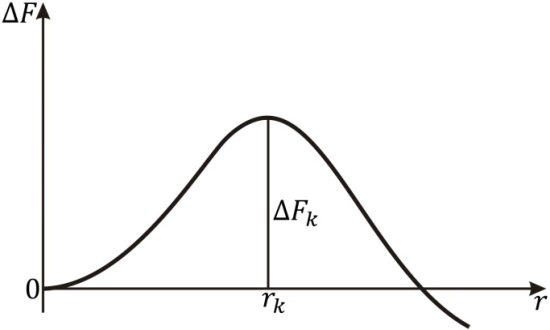
Зависимость
изменения свободной энергии
от
радиуса r
зародыша показана на рис. 8.11. Из соотношения
(8.4) следует, что равновесие системы
кристалл-расплав является неустойчивым.
Это наглядно видно из кривой
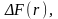 имеющей максимум при радиусе
имеющей максимум при радиусе
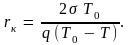
Этот радиус определяет критический размер зародыша. Все цен-
Рис. 8.11 |
 определяет работу А
образования зародыша. Представим r3
в первом члене правой части (8.4) в виде
r2rк
и, подставив затем вместо rк,
получим
определяет работу А
образования зародыша. Представим r3
в первом члене правой части (8.4) в виде
r2rк
и, подставив затем вместо rк,
получим
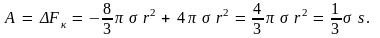
Как
видим, эта работа равна
 поверхностной энергии зародыша.
поверхностной энергии зародыша.
Работа образования зародыша обусловливает существование термодинамического потенциального барьера образования зародыша. Наличие такого барьера предопределяет склонность системы к переохлаждению. Процесс кристаллизации в таком случае можно вызвать путем введения кристаллической затравки, т.е. небольшого кристалла того же самого вещества. Случайные примеси в виде твердых частиц в расплаве также могут служить центрами кристаллизации. В отсутствие примесей возможно самопроизвольное образование зародышей за счет энергии тепловых флуктуаций. Вероятность образования зародыша С в этом случае определяется формулой Больцмана
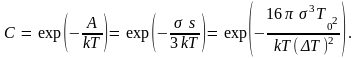
Эта
вероятность растет с увеличением степени
переохлаждения
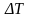 .
.
Наблюдения показывают, что при охлаждении расплава до температуры кристаллизации масса расплава переходит в кристаллическое состояние не мгновенно и не одновременно во всем объеме. Кристаллизация развивается из одного или нескольких центров и распространяется с конечной скоростью, захватывая постепенно весь объем неустойчивой фазы.