
- •Глава 8
- •8.1. Кристаллические и аморфные тела
- •8.2. Кристаллические структуры
- •8.3. Дефекты кристаллов
- •8.4. Механические свойства твердых тел
- •8.4.1. Деформация твердых тел
- •8.4.2. Прочность твердых тел
- •8.4.3. Распространение упругих волн в твердых телах
- •8.5. Тепловые свойства твердых тел
- •8.5.1. Тепловое расширение твердых тел
- •8.5.2. Теплоемкость твердых тел
- •8.6. Плавление и кристаллизация
- •8.7. Тройная точка. Полиморфные превращения
8.7. Тройная точка. Полиморфные превращения
Как уже говорилось, равновесие двух фаз возможно лишь при вполне определенном соотношении между температурой и давлением; эта зависимость выражается определенной кривой в плоскости рТ. Очевидно, что три фазы одного и того же вещества уже не могут находиться одновременно в равновесии друг с другом вдоль целой линии. Такое равновесие возможно лишь в одной определенной точке на диаграмме рТ, т.е. при вполне определенных значениях давления и температуры. Действительно, в случае равновесия трех фаз (твердой 1, жидкой 2 и газообразной 3) должно выполняться равенство их химических потенциалов:
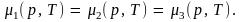
Откуда получаем три уравнения:
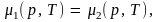
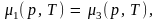
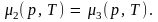
Первое из этих уравнений определяет кривую равновесия твердого тела и жидкости, второе – твердого тела и газа и третье – жидкости и газа. Любая пара из этих уравнений представляет собой систему двух уравнений с двумя неизвестными р и Т. Она имеет решение при вполне определенных значениях этих переменных; обозначим их ртр и Ттр. Следовательно, состояние, в котором одновременно сосуществуют три фазы, представляет собой одну точку, называемую тройной точкой. На диаграмме рТ она изображается точкой, являющейся точкой схождения кривых равновесия р = р(Т) каждых двух из трех фаз (рис. 8.12, а). Изображенная на рис. 8.12, а фигура, называется фазовой диаграммой. Области 1, 2, 3 – области трех однородных фаз, разделяющие их линии – кривые равновесия соответствующих двух фаз. Наклон кривой плавления изображен для тела, расширяющегося при плавлении.
Из фазовой диаграммы видно, что твердое вещество, чтобы превратиться в газ при нагревании, не обязательно должно проходить через стадию жидкого состояния. При давлениях ниже тройной точки нагревание твердого тела превращает его непосредственно в пар; такой фазовый переход называется сублимацией (или возгонкой). Кривая равновесия жидкости и газа заканчивается в критической точке (точка К на рис. 8.12, а). Для переходов же между жидкой и твердой фазами существование критической точки невозможно. Поэтому кривая плавления не может просто окончиться и должна продолжаться неограниченно. Кривая равновесия твердого тела с газом уходит в начало координат, т.е. при абсолютном нуле температуры вещество при любом давлении находится в твердом состоянии.
Область твердого состояния не является обычно вся одной и той же фазой. При различных давлениях и температурах вещество может находиться в различных кристаллических состояниях, каждое из которых характеризуется своей определенной кристаллической структурой (полиморфизм). Как и всякие фазы, различные модификации имеют свои области равновесия. Две различные модификации могут находиться в равновесии друг с другом лишь вдоль определенных линий на диаграмме рТ, т.е. при определенной зависимости давления от температуры. Три фазы, например, две кристаллические и одна жидкая, могут находиться в равновесии лишь в определенной тройной точке, т.е. при строго заданных значениях давления и температуры. Таких тройных точек на диаграмме состояния может быть несколько. На рис. 8.12, б в качестве примера схематически изображена фазовая диаграмма серы. Кристаллическая сера может существовать в двух формах. Поэтому на диаграмме состояния имеются две области устойчивости твердого состояния, обозначенные символами 1 и 1′. Как видим, в этой системе число тройных точек на диаграмме равно трем.
Переход
вещества из одной кристаллической
модификации в другую называется
полиморфным превращением. Он является
фазовым переходом первого рода, так как
сопровождается поглощением или выделением
тепла. Так, превращение α-железа
в γ-железо
происходит при атмосферном давлении
при 910 0С
и сопровождается поглощением тепла
около
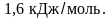 При
любом фазовом превращении в твердом
состоянии происходит перестройка
атомной структуры системы, а на это
требуется определенное количество
теплоты.
При
любом фазовом превращении в твердом
состоянии происходит перестройка
атомной структуры системы, а на это
требуется определенное количество
теплоты.
При полиморфном превращении часто возникают метастабильные состояния. Это связано с тем, что тепловое движение частиц в кристалле представляет собой малые колебания этих частиц вблизи узлов решетки, совершающиеся с небольшими амплитудами. Из-за малости амплитуд перестройка решетки кристалла при низких температурах затруднена. Она облегчается при повышении температуры. Поэтому при фазовых переходах, связанных с нагреванием вещества, метастабильные состояния возникают редко. При обратных переходах, происходящих при охлаждении вещества, значительно чаще сохраняется высокотемпературная фаза в той области температур, где эта фаза уже неустойчива.
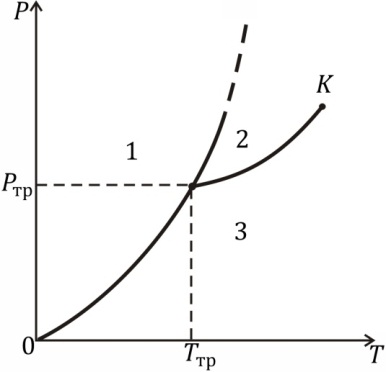
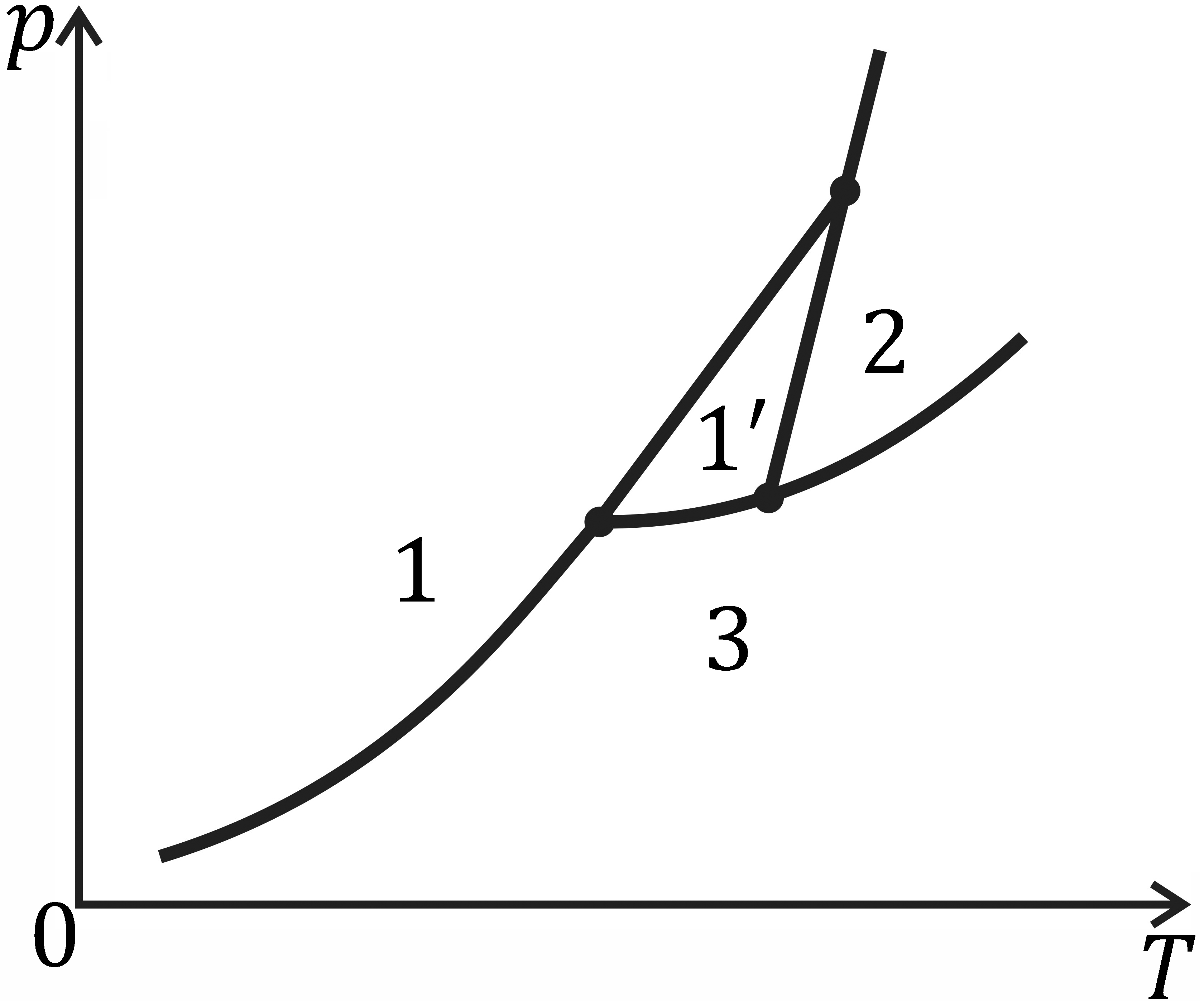
а) б)
Рис. 8.12
Переход
между различными кристаллическими
модификациями совершается обычно таким
образом, что происходит скачкообразная
перестройка кристаллической решетки
и состояние тела испытывает скачок.
Однако наряду с такими скачкообразными
переходами возможен и другой тип
переходов, связанный с изменением
симметрии. Для пояснения этого рассмотрим
воображаемый пример. Представим себе
тело, которое при низких температурах
имеет тетрагональную структуру, т.е.
структуру с решеткой, элементарной
ячейкой которой служит прямоугольный
параллелепипед с квадратным основанием
и с высотой с,
отличной от ребра основания а,
причем
 Предположим также, что при нагревании
тела ребро а
удлиняется быстрее высоты с.
Тогда при некоторой температуре длины
всех сторон сравняются и параллелепипед
превратится в куб, изменится симметрия
кристалла. Мы получаем по существу
другую кристаллическую модификацию.
Предположим также, что при нагревании
тела ребро а
удлиняется быстрее высоты с.
Тогда при некоторой температуре длины
всех сторон сравняются и параллелепипед
превратится в куб, изменится симметрия
кристалла. Мы получаем по существу
другую кристаллическую модификацию.
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
Астахов А.В. Курс физики. Механика. Кинетическая теория материи. –М.: физматгиз, 1977. -384 с.
Базаров И.П. Термодинамика. –М.: Высшая школа, 1991. -376 с.
Василевский А.С., Мултановский В.В. Статистическая физика и термодинамика. –М.: Просвещение, 1985. -256 с.
Гершензон Е.М., Малов Н.Н., Мансуров А.Н., Эткин В.С. Курс общей физики. Молекулярная физика. –М.: Просвещение, 1982. -208 с.
Жданов Г.С., Хунджуа А.Г. Лекции по физике твердого тела. –М.: Изд. МГУ, 1988. -232 с.
Кикоин А.К., Кикоин И. К. Молекулярная физика. –М.: Наука, 1976. 176 с.
Ландау Л.Д., Ахиезер А.И., Лифшиц Е.М. Курс общей физики. Механика и молекулярная физика. –М.: Наука, 1965. -384 с.
Орлов В.А., Никифоров Г.Г. Равновесная и неравновесная термодинамика: Учебное пособие. –М.: БИНОМ. Лаборатория знаний, 2005. -120 с.
Пригожин И. От существующего к возникающему. –М.: Изд УРСС научной и учебной литературы, 2002. -288 с.
Рейф Ф. Статистическая физика. –М.: Наука, 1977. -324с
Румер Ю.Б., Рывкин М.Ш. Термодинамика статистическая физика и кинетика. –М.: Наука, 1977.-551с.
Седов Е.А. Одна формула и весь мир. –М.: Знание, 1982.-176 с.
Степухович А.Д., Улицкий В.А. Лекции по статистической физике. –М.: Высшая школа, 178.-150 с.
Стратонович Р.Л., Полякова М.С. Элементы молекулярной физики, термодинамики и статистической физики. –М.: изд. МГУ, 1981. -176 с.
Сущинский М.М. Курс физики, т. 1. -М.: Наука, 1973.
-352 с.
Тер Хаар Д., Вегеланд Г. Элементарная термодинамика. –М.: Мир,1968. -220 с.
Хуанг К. Статистическая механика. –М.: Мир, 1966.
-520 с.
Шебалин О.Д. Молекулярная физика. –М.: Высшая школа, 1978. -168 с.
