- •Глава 7
- •7.1. Реальные газы. Уравнение Ван-дер-Ваальса
- •7.2. Внутренняя энергия реального газа
- •7.3. Изотермы Ван-дер-Ваальса. Критическая точка. Метастабильные состояния
- •7.4. Жидкости. Свойства жидкостей
- •7.5. Поверхностное натяжение жидкостей
- •7.6. Взаимные превращения жидкости и газа
- •7.7. Термодинамическое описание фазового перехода пар – жидкость
- •7.8. Диаграмма состояния двухфазной системы
- •7.9. Роль поверхностных эффектов в явлении
7.9. Роль поверхностных эффектов в явлении
конденсации
Как уже отмечалось, при изотермическом сжатии газа, в некоторой точке 1, показанной на pV- диаграмме на рис. 7.3, должна начаться его конденсация. При дальнейшем сжатии давление в системе должно оставаться постоянным. В действительности же давление иногда продолжает расти вдоль кривой 1–2. Однако состояния системы на этой кривой не являются стабильными. Задержка в конденсации объясняется поверхностными эффектами, т.е. тем, что образование в паре вследствие флуктуаций зародышей (капель жидкости) малых размеров жидкой фазы из-за поверхностной свободной энергии этих зародышей приводит к увеличению свободной энергии системы, и поэтому фазовый переход оказывается термодинамически невыгодным. Конденсация начинается, когда образуются капли жидкости некоторых критических размеров, начиная с которых они будут расти. Найдем этот критический размер зародыша.
Предположим, что в результате происшедшей флуктуации в паре при температуре Т и давлении р образовалась капелька жидкости радиуса R. Потенциал Гиббса пара до образования капли равен
G0 = = μ2(p, T)N,
где μ2 – химический потенциал пара, N – число частиц пара. После образования капли потенциал Гиббса системы с учетом поверхностной энергии будет
G = F + pV = N1f1 + N2f2 + σS + p(N1v1 + N2v2) = N1(f1 + pv1) +
+
N2(f2
+ pv2)
+
 = N1μ1
+ N2μ2
+
,
= N1μ1
+ N2μ2
+
,
где N2 – число частиц пара, N1 – число частиц в капле (N1 + N2 =
Рис. 7.11 |
∆G = G – G0 =
= (μ1 – μ2)N1 + σS.
Выразив N1
и S
через радиус капли, получим
 С учетом этого будем иметь
С учетом этого будем иметь
|
(7.8) |
Возможны
два случая: 1)
 ;
2)
.
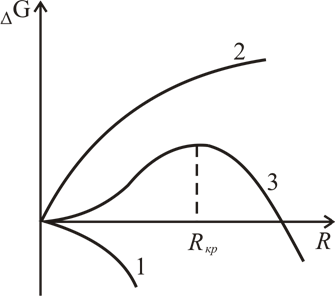
На рис. 7.11 приведена
зависимость ΔG
от радиуса капли R
для случая
;
2)
.
На рис. 7.11 приведена
зависимость ΔG
от радиуса капли R
для случая
 <
<
 .
Кривая 1 соответствует первому члену в
правой части равенства (7.8), а кривая 2 –
второму члену. Суммарная кривая 3
дает зависимость изменения термодинамического
потенциала системы от размера зародыша.
В случае, когда
.
Кривая 1 соответствует первому члену в
правой части равенства (7.8), а кривая 2 –
второму члену. Суммарная кривая 3
дает зависимость изменения термодинамического
потенциала системы от размера зародыша.
В случае, когда
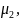 новая фаза (жидкость)
имеет при заданных р
и Т химический
потенциал больший, чем старая (пар), и
является менее устойчивой. Появление
капельки жидкости в паре при всех ее
размерах R
ведет к росту ∆G,
поэтому образование новой фазы всегда
термодинамически невыгодно.
новая фаза (жидкость)
имеет при заданных р
и Т химический
потенциал больший, чем старая (пар), и
является менее устойчивой. Появление
капельки жидкости в паре при всех ее
размерах R
ведет к росту ∆G,
поэтому образование новой фазы всегда
термодинамически невыгодно.
Рис. 7.12 |

Получим
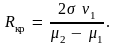
Отсюда
видно, что критический радиус зародыша
пропорционален коэффициенту поверхностного
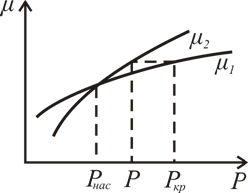
натяжения. На рис. 7.12 изображена кривая
зависимости химического потенциала μ
от давления p
при T = const
для жидкой (кривая
)
и газообразной (кривая
)
фаз. Абсцисса точки пересечения кривых
равна давлению насыщенного пара
 .
Из этого рисунка видно, что разность
.
Из этого рисунка видно, что разность
 тем больше, чем больше степень пересыщения
пара
тем больше, чем больше степень пересыщения
пара
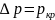 – p. Таким
образом, чем больше пересыщен пар,
тем
– p. Таким
образом, чем больше пересыщен пар,
тем
1 В твердом теле, как мы увидим далее, могут распространяться помимо продольных вон еще две поперечные волны со взаимно перпендикулярными направлениями колебаний.