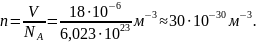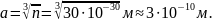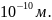- •Глава 1. Введение в молекулярную физику
- •Глава 2. Молекулярно-кинетическая теория газов
- •2.3. Молекулярно-кинетический смысл абсолютной температуры………………………………………………......28
- •2.4. Закон равнораспределения энергии по степеням свободы молекулы…………………………………………...30
- •Глава 3. Статистические распределения
- •Глава 4. Явления переноса в газах
- •Глава 5. Первое начало термодинамики
- •Глава 6. Второе и третье начала термодинамики
- •Глава 7. Реальные газы и жидкости
- •Глава 8. Твердые тела
- •Глава 1
- •Статистический и термодинамический методы
- •1.2. Массы и размеры молекул
- •1.3. Термодинамическая система. Термодинамические состояния и процессы
- •Основные понятия и теоремы теории
1.2. Массы и размеры молекул
В молекулярной
физике принято характеризовать массы
атомов и молекул не их абсолютными
значениями, например в килограммах, а
относительными безразмерными величинами
– относительными атомной Ar
и молекулярной Mr
массами. В качестве атомной единицы
массы (а.е.м., или mu)
принимается 1/12 массы mC
изотопа углерода 12C:
mu
= mC
/12 = 1,66⋅10
–27
кг. Следовательно, масса любого атома
равна m
= muA
= 1,66⋅10
–27 ,
где А
– атомная масса элемента. Например,
для водорода А
= = 1,00797 кг и масса его атома
,
где А
– атомная масса элемента. Например,
для водорода А
= = 1,00797 кг и масса его атома
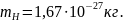 Относительной
атомной массой Ar
называют отношение абсолютного значения
массы данного атома к атомной единице
массы. Аналогично определяется и
относительная молекулярная масса Mr
= m/mu,
где m
– абсолютная масса молекулы.
Относительной
атомной массой Ar
называют отношение абсолютного значения
массы данного атома к атомной единице
массы. Аналогично определяется и
относительная молекулярная масса Mr
= m/mu,
где m
– абсолютная масса молекулы.
В молекулярной физике широко используется понятие количества вещества, выражаемое в молях. Моль равен такому количеству вещества, которое содержит столько же структурных элементов (атомов, молекул), сколько их атомов содержится в 0,012 кг изотопа углерода 12C. Следовательно, моль любого вещества содержит, по определению, одинаковое число структурных элементов, которое называют постоянной Авогадро, или числом Авогадро:
|
В молекулярной физике помимо относительной молекулярной массы часто используют молярную массу, т.е. массу вещества, взятого в количестве одного моля. Молярная масса M равна произведению массы молекулы данного вещества m на число Авогадро NA: M = mNA. Она имеет разное значение для каждого вещества, но всегда содержит одинаковое число молекул. Молярная масса вещества, состоящего из одноатомных молекул, содержит одинаковое число атомов, и ее в этом случае называют атомной массой. Для углерода (12C) молярная масса в точности равна 0,012кг/моль и, следовательно, масса его атома:
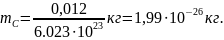
Молярную массу
M
можно выразить через относительную
молекулярную массу Mr.
Так как относительная молекулярная
масса
|

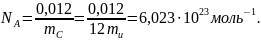
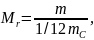 то масса молекулы
то масса молекулы
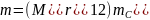 .
Следовательно, молярная масса
.
Следовательно, молярная масса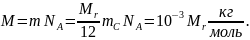
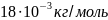 ,
а так как плотность воды
,
а так как плотность воды
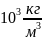 ,
то 1 моль воды занимает объем
,
то 1 моль воды занимает объем
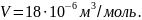 В этом объеме содержится NA
молекул, а число молекул в единице
объема равно
В этом объеме содержится NA
молекул, а число молекул в единице
объема равно