
Лабораторна робота 2
.docЛАБОРАТОРНА РОБОТА 2.
БІОЛОГІЧНІ МЕТОДИ ВИЗНАЧЕННЯ КІЛЬКОСТІ АНТИБІОТИКІВ (ЗАКІНЧЕННЯ).
ВИЗНАЧЕННЯ ЧУТЛИВОСТІ МІКРООРГАНІЗМІВ ДО ДІЇ
АНТИБІОТИКІВ (ЗАКІНЧЕННЯ).
БІОТЕХНОЛОГІЯ ОТРИМАННЯ ХЛОРТЕТРАЦИКЛІНУ (ПОЧАТОК).
Розрахунок кількості антибіотика при аналізі розчину методом дифузії.
Біологічну активність антибіотиків розраховують за допомогою стандартної кривої. Для побудови стандартної кривої використовують п`ять концентрацій стандартного препарату. Одна з концентрацій, за якою вносять поправки для всіх інших концентрацій, є контрольною. Застосовувані для побудови кривої концентрації не повинні відрізнятися від контрольної концентрації більш як на 40 або 50 %. Для кожної концентрації, крім контрольної, використовують три чашки. У три циліндри або лунки кожної чашки вносять розчин контрольної концентрації, у три інші – одну з узятих концентрацій стандарту. Після вимірювання зон затримання росту для кожної концентрації виводять середній розмір зони з трьох чашок, потім виводять середній розмір зони для контрольної концентрації з усіх чашок (36 зон).
За різницею між середнім розміром зони контрольної концентрації, виведеної з усіх чашок, і середнім розміром зони контрольної концентрації, виведеної з трьох чашок із кожною окремою концентрацією, визначають поправку до розміру зони даної концентрації. Знайдену поправку додають до середнього розміру зони даної концентрації, якщо вона позитивна, і віднімають, якщо вона негативна.
Приклад 1. Середній розмір зони для контрольної концентрації 1 од/мл, виведений із 36 зон, дорівнює 19,2 мм. Середній розмір зони для тієї самої концентрації, виведений із трьох чашок, на яких випробовувався розчин із концентрацією 0,8 од/мл, дорівнює 19 мм. Отже, розмір поправки буде +0,2 мм. Середній розмір зони для концентрації 0,8 од/мл дорівнює 17,9 мм; збільшуючи поправку +0,2, одержують розмір 18,1 мм. Таким самим способом виправляють значення розміру зони для всіх концентрацій.
За виправленими значеннями розмірів зон узятих концентрацій і середнім розміром зони контрольної концентрації з усіх чашок будують стандартну криву за напівлогарифмічною сіткою розрахунку активності антибіотиків, відкладаючи на осі абсцис величини зон проти показань відповідних концентрацій на осі ординат. Якщо умови досліду залишаються постійними, то стандартною кривою можна користуватися протягом тривалого часу, час від часу повторюючи кут нахилу кривої за двома концентраціями на трьох-п`яти чашках. Для визначення активності препарату готують одне розведення з концентрацією, близькою до контрольної концентрації стандарту. Для кожного випробування готують не менше п’яти чашок. У три циліндри кожної чашки або лунки вносять випробуваний розчин досліджуваного препарату, а в три інші – контрольну концентрацію стандартного препарату.
Після інкубації заміряють зони пригноблення, утворені контрольною концентрацією стандарту і випробуваного розчину препарату. Знаходять середнє значення розмірів зон із трьох чашок. Різницю між знайденими середніми
розмірами зон випробуваного розчину препарату і контрольною концентрацією додають до значення розміру зони контрольної концентрації на кривій. Потім за кривою знаходять концентрацію, що відповідає знайденій величині зон (од/мл). Множенням отриманої концентрації на ступінь розведення одержують вміст од (активність) у 1 см3 основного розчину або в 1 мг препарату.
Приклад 2. Середній розмір зони для випробуваного препарату стрептоміцину сульфату при розведенні 1:300 18,6 мм, середній розмір зон для 2 од/мл стандартної кривої, що відповідає 18,2 мм, дорівнює 18,8 мм. Знаходять на кривій концентрацію, що відповідає даному розміру зони 2,36 од. Цей розмір множать на ступінь розведення й одержують вміст од у 1 мл основного або в 1 мг випробуваного препарату, тобто 2,36 од х 300 = 708 од/мг.
Біотехнологія отримання хлортетрацікліну.
Тетрацикліни зберігають до сьогодні важливе значення при лікуванні захворювань дихальних шляхів, спричинених хламідіями, рикетсіями, спірохетами, мікоплазмами, що є стійкими до інших антибіотиків. Крім цього, деякі тетрациклінові антибіотики використовуються в сільському господарстві.
Хлортетрациклін (біоміцин) належить до антибіотиків тетрациклінового ряду і має наступну будову:
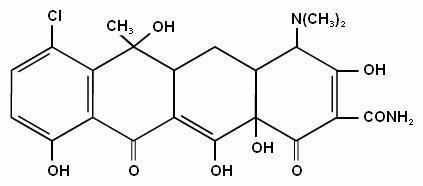
Вперше було виділено у 1948 році Б.Дуггаром і названо ауреоміцином. Продуцент Streptomyces aureofaciens. Після вивчення хімічної будови дано назву хлортетрациклін (ХТЦ). Випускається промисловістю під назвами біоміцин, ауреоміцин, дуоміцин, біовіт.
S. aureofaciens – аероб, оптимальна температура розвитку 26–28ºС, крім хлортетрацикліну накопичує вітамін В12, тетрациклін і інші антибіотичні речовини.
ХТЦ має найбільшу активність при рН 3,5–4, в лужному середовищі досить швидко руйнується. Дія ХТЦ бактеріостатична. ХТЦ застосовується тільки як антибіотик для ветеринарії, бо, незважаючи на його активність проти коклюшу і дифтерії, він є високотоксичним препаратом.
Культура S. aureofaciens в якості джерела вуглецю використовує крохмаль, декстрини, мальтозу, фруктозу, не засвоює лактозу, цукрозу, арабінозу. Найбільш ефективне джерело вуглецю – глюкоза.
Компонентами комплексного середовища для одержання ХТЦ є крохмаль, соєве борошно, кукурудзяне борошно. Альтернативне джерело вуглецю – оцтова, молочна, янтарна кислоти або багатоатомні спирти – манніт, сорбіт, гліцерин, тваринні і рослинні жири. Тваринні і рослинні жири одночасно є піногасниками.
Амонійні солі при біосинтезі ХТЦ можуть бути єдиним джерелом азоту. Культура має досить розвинений протеолітичний комплекс і тому може засвоювати
органічні джерела азоту – поліпептиди, амінокислоти. Найбільш ефективний варіант – присутність в середовищі як органічного, так і неорганічного азоту.
Як джерело фосфору використовують кукурудзяний екстракт. На синтетичних середовищах використовують фосфорнокислі солі.
Біосинтезу ХТЦ сприяє молочна кислота, джерелом якої є кукурудзяний екстракт. Метали – магній, залізо, цинк, мідь додають в синтетичні середовища у вигляді солей, в комплексні середовища ці елементи не додають.
Негативно впливає на біосинтез тетрацикліну надлишок неорганічного фосфору в середовищі, при цьому прискорюються ріст продуцента, споживання вуглеводів, відбувається накопичення піровиноградної і оцтової кислот і зменшується антибіотична активність.
Середовище для культивування має рН 6,6–7,2. Процес біосинтезу ХТЦ відбувається при рН 5,5–7,2 температурі 27–28ºС. Необхідною є посилена аерація в порівнянні з іншими випадками, а припинення аерації навіть на незначний термін призводить до припинення біосинтезу.
Після ферментації відбувається відділення міцеліальної маси, яку потім знімають з фільтрів і висушують на парових сушарках. Іншим способом культуральну рідину без фільтрації висушують на розпилюючій сушарці. Більша частина ХТЦ знаходиться в міцелії. ХТЦ, який знаходиться в культуральній рідині, можна осадити при простому підкисленні при рН 7,5-8,0. Товарний препарат одержують висушуванням вологого осаду, який надходить з фільтрпресів.
ХТЦ витримує температуру 100ºС, тому для його отримання в сухому вигляді сушіння триває 3,5-4 години і значення кінцевої вологості препарату 6%. Сушильним агентом є повітря (40-50ºС в стрічкових сушарках, в розпилювальній сушарці температура до 200ºС).
Для сільського господарства випускається препарат «Біовіт».
Загальний вигляд – однорідний порошок коричневого кольору зі специфічним запахом нерозчинний у воді. В 1 г препарату «Біовіт – 120» міститься 120 мг ХТЦ та не менше ніж 120 г вітаміну В12. В 1 г «Біовіт – 80» - 80 мгХТЦ та не
менше ніж 8 мкг В12. «Біовіт – 40» - 40 мг ХТЦ та не менше 40 мкг В12.
Для промислового культивування S. aureofaciens використовується
|
середовище такого складу, %: |
|
|
Кукурудзяне борошно |
4 |
|
NH4NO3 |
0,7 |
|
CaCO3 |
0,4 |
|
NaCl |
0,3 |
|
Кукурудзяний екстракт |
0,3 |
Вихідне рН середовища 6,6, тривалість ферментації – 60 – 72 год. Перед посівом у середовище стерильно добавляють роданистий бензил (0,0001 % до об'єму середовища), розчинений у стерильній олії, що є стимулятором утворення ХТЦ.
Посівний матеріал для виробництва хлортетрацикліну готують на спеціальних посівних станціях, де продуцент S. aureofaciens вирощують на розпареному пшоні в спеціальних флаконах до утворення великої кількості спор. Запарафіновані флакони з паспортом надходять на заводи, що виробляють антибіотики, де використовуються як вихідний посівний матеріал.
Завдання для виконання студентами Біологічні методи визначення кількості антибіотиків (закінчення)
-
Виміряти зони затримки росту тест-культури та побудувати графік залежності концентрації антибіотика та діаметру зони затримки росту.
-
Використовуючи побудований графік визначити вміст антибіотика в розчині з невідомою концентрацією.
Визначення чутливості мікроорганізмів до дії антибіотиків (закінчення)
-
Виміряти діаметри зон затримки росту мікроорганізмів.
-
Скласти таблицю із зазначенням чутливості досліджуваних культур мікроорганізмів до антибіотиків. Пояснити отримані результати.
Облік результатів. Після інкубації чашки поміщають догори дном на темну матову поверхню так, щоб світло падало на них під кутом 45 град. (облік у відбитому світлі). Діаметр зон затримки росту виміряють з точністю до 1 мм (бажано користуватися штангенциркулем або кронциркулем).
При вимірюванні зон затримки росту орієнтуються на зону повного пригнічення видимого росту. Не слід звертати увагу на дуже дрібні колонії, які виявляються в межах зони затримки росту тільки за особливих умов освітлення або збільшення, і ледь помітний наліт біля краю зони. Винятком є результати визначення чутливості стафілококів до оксациліну, коли необхідно враховувати і найдрібніші колонії, виявлені в межах чіткої зони пригнічення росту.
Крупні колонії в межах чіткої зони пригнічення росту свідчать про наявність сторонньої мікрофлори або про гетерорезистентність популяції мікроорганізмів, в цьому випадку необхідно повторити ідентифікацію мікроорганізму, що формує цю колонію, і визначення чутливості цього штаму.
При визначенні чутливості ДДМ штамів протеїв, що рояться, зона пригнічення росту може бути затягнутою тонкою вуалеподібною плівкою, яка не заважає встановленню межі зони і не враховується при реєстрації результатів.
При визначенні чутливості до сульфаніламідів і їх комбінації з триметопримом межу зони пригнічення росту враховують на рівні пригнічення росту на 80%. Це пов'язано з тим, що під дією цих препаратів перед повним пригніченням росту можливо завершення 1-2 циклів проліферації мікроорганізму.
Для ідентифікації і тестування чутливості мікроорганізмів до антибіотиків можна використовувати мікробіологічні аналізатори, зареєстровані і дозволені до використання в Україні
Біотехнологія отримання хлортетрацикліну (початок).
Приготування поживного середовища. Актиноміцетам для розвитку потрібні певні співвідношення вуглецю та азоту в середовищі. Вони чутливі до сольового складу і наявності стимуляторів росту.
Джерелом вуглецю під час культивування S. aureofaciens є крохмаль, борошно, цукор, гліцерин. Як джерело азоту використовують NH4NO3 чи
(NH4)2SO4.
Кукурудзяний екстракт покриває нестачу органічного азоту і ростових речовин. До складу поживного середовища входять сіль і крейда.
Варіанти середовищ наведено в таблиці 2.1.
Розчин роданистого бензилу готують так: наважку 5 мг розчиняють у 25 мл стерильної олії і по 0,5 мл вносять у стерильне поживне середовище.
Для кожного варіанта готують 250 мл поживного середовища. Спочатку зважують кукурудзяний екстракт і розчиняють у 30 – 40 мл киплячої водопровідної води, вносять наважки солей (останньою – крейду). Об'єм доводять до 130 – 150 мл і нагрівають до кипіння, після чого добавляють джерело вуглецю (борошно чи крохмаль попередньо змішують з 50 мл води і при постійному перемішуванні вливають киплячу рідину до повної клейстеризації крохмалю). Потім об'єм середовища після охолодження до 40 ºС доводять до 260 мл (враховуючи розширення при 40 ºС). Відразу після перемішування поживне середовище розливають по 100 мл у колби місткістю 750 мл і готують до стерилізації.
Визначення рН середовища. У поживному середовищі, що залишилося, визначають рН потенціометрично. рН середовища повинно бути 6,6. Якщо рН середовища відрізняється від вказаної величини, добавляють 1 н. розчин NaOH чи 1 н. розчин HCl .
Підготовка й стерилізація посуду. Стерилізація поживного середовища.
Для першого заняття слід мати стерильний бюкс для наважки роданистого бензилу, шпатель, ложку для засівання, мірну колбу на 25 мл, піпетку на 1 мл (градуйовану), колбу з олією.
Всі перелічені предмети та посуд повинні бути чисті й сухі. Потім кожен предмет окремо загортають у папір.
Колбу з олією закривають ватно-марлевою пробкою і зверху папером. Колби з поживним середовищем закривають ватно-марлевими пробками та папером, на якому простим олівцем пишуть номер варіанта і прізвище студента. Підготовлений посуд і поживні середовища завантажують в автоклав. Поживне середовище і посуд стерилізують під тиском 0,1 мПа протягом 30 хв.
Засів середовища та внесення стимулятора. Перш ніж зробити засів,
готують розчин стимулятора. В стерильний бюкс стерильним шпателем беруть наважку роданистого бензилу в кількості 5 мг і переносять у стерильну мірну колбу на 25 мл, розчиняють у стерильній олії і доводять олією до риски.
Засів проводять удвох, попередньо підготувавши все для стерильної роботи:
-
У кожну колбу з середовищем вносять піпеткою по 0,5 мл олії зі стимулятором, дотримуючись правил асептики.
-
Відбирають із флакона стерильною ложкою п’ять – шість зерен пшона і вносять у колбу з середовищем. Ложку обпалюють над полум'ям і засівають іншу колбу.
Засіяні колби закривають пробками, підписують і ставлять на качалку при температурі 28 ºС.
