
Лекція2
.pdfОсновні терміни і поняття
Успішна робота в галузі виробництва ліків, підготовки кадрів і підтримання юридичної законності дій в фармацевтиці в цілому можлива тільки за умови правильного розуміння і застосування термінів. Вільне тлумачення термінів неприпустиме.
Варто зупинитися на змісті основних (базових) термінів, таких як "лікарська речовина", "лікарський засіб", "лікарська форма", "лікарський препарат", "ліки" і деяких інших, найбільш широко використовуваних у навчальній і довідковій літературі, виробничій діяльності (при складанні нормативно-технічної документації).
Лікарський засіб (лікарська субстанція) – речовина (суміш речовин) природного, синтетичного або біотехнологічного походження, що має певну біологічну активність і дозволена для медичного застосування й виробництва з метою діагностики, профілактики або лікування захворювань у людини або тварин або зміни стану і функцій організму.
Дуже часто замість термінів "лікарський засіб", "лікарська субстанція" або "лікарська речовина" вживають термін-синонім "діюча речовина".
Лікарські засоби (речовини, субстанції), як і готові лікарські препарати, залежно від ступеня прояву ними біологічної активності або, точніше, ступеня токсичності прийнято розділяти на отрутні, включаючи наркотичні (зберігаються за списком А), сильнодіючі (зберігаються за списком Б) і звичайні лікарські засоби.
Отрутний засіб – лікарський засіб з дуже високою біологічною активністю, прописування, відпускання, зберігання й облік якого проводиться за особливими правилами, встановленими МОЗ, включений в список А (отрутні лікарські засоби).
Сильнодіючий засіб – лікарський засіб з високою біологічною активністю, прописування, відпускання, зберігання й облік якого проводиться за особливими правилами, встановленими МОЗ, включений в список Б (сильнодіючі лікарські засоби).
Наркотичний засіб – отрутний або сильнодіючий лікарський засіб, що вимагає обмеженого застосування й віднесений до наркотичного відповідно до законодавства. Наркотичні засоби реалізують за особливими правилами, встановленими МОЗ.
Радіоактивний засіб – лікарський засіб, який застосовують у медичній практиці завдяки його здатності до іонізуючого випромінювання.
Діючі речовини (субстанції, лікарські речовини) – біологічно активні речовини, які можуть змінювати стан і функції організму або мають профілактичну, діагностичну або лікувальну дію і використовуються для виробництва готових лікарських препаратів.
Допоміжна речовина – відносно індиферентна в хімічному й біологічному відношенні речовина, дозволена для медичного застосування з метою одержання лікарської форми, для надання або збереження певних властивостей лікарського препарату. (Допоміжні речовини – речовини, які в кількості, що використовуються, не виявляють лікувального ефекту та
сприяють виробництву, виготовленню та зберіганню лікарських засобів або їхньому застосуванню та виявляють позитивну дію на фармакокінетичні властивості субстанцій, що входять до складу лікарського препарату).
Лікарська (фармацевтична) сировина – лікарські засоби, лікарська рослинна сировина, допоміжні речовини, дозволені до медичного застосування для виробництва лікарських препаратів або іншої фармацевтичної продукції або напівфабрикатів. Фактично до сировини належать всі вихідні матеріали, що надходять у виробництво для перероблення з метою одержання готового продукту або напівфабрикату.
Лікарська форма – проміжний стан, що наданий лікарським і допоміжним речовинам у процесі одержання лікарського препарату з метою досягнення оптимальної лікувальної дії.
Лікарський препарат (ліки, медикамент) – лікарська форма, розфасована, упакована й промаркірована відповідно до вимог нормативнотехнічної документації, зручна для медичного застосування, транспортування й зберігання, має певний термін придатності.
Готова продукція – продукція, що отримана за допомогою технологічного оброблення субстанцій та допоміжних речовин, лікарської рослинної сировини, пройшла всі стадії технологічного процесу, включаючи пакування й маркування та контроль якості.
Готовий лікарський препарат (ліки, медикамент) – дозована лікарська форма в тому вигляді й стані, у якому застосовується.
Таким чином, використовуючи лікарський засіб і допоміжну речовину, після певних технологічних операцій можна одержати лікарську форму (розчин, мазь, таблетки тощо). Кінцевим продуктом технологічного процесу (іноді дуже складного) є лікарський препарат.
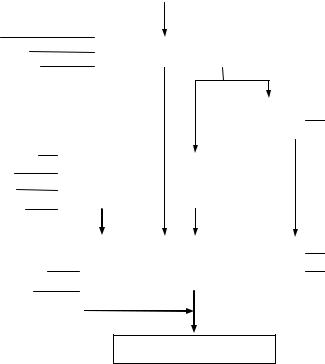
Схема взаємозв’язку основних термінів і понять (Рис. 1) відображає найбільш характерні показники технологічних процесів виробництва ліків.
Аналітичний нормативний документ (АНД) – нормативний документ,
що визначає якісні і кількісні показники лікарського засобу, їх допустимі межі відхилень та методики проведення випробувань, встановлює вимоги до упаковки, маркування, умов зберігання, транспортування, терміну придатності лікарського препарату.
Біодоступність – повнота й швидкість всмоктування лікарської речовини, яка характеризується кількістю, що надійшла до організму, після застосування лікарського препарату.
Біоеквівалентність – рівність біодоступності в допустимих межах тих самих лікарських препаратів, виготовлених різними виробниками.
Біологічно активна добавка – речовини або їх суміші, що використовуються для надання раціону харчування спеціальних дієтичних чи лікувально-профілактичних властивостей, вміст яких не перевищує рекомендовану дозу активної речовини. Для вітамінів та мінеральних елементів допускається перевищення фізіологічної потреби не більше ніж в три рази.
Валідація – оцінка й документальне підтвердження відповідності виробничого процесу і якості продукції затвердженим вимогам.
|
|
|
|
|
Фармакологічний засіб |
|
|
|
|
|||||
Отрутний |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Лікарський засіб |
|
|
|
|
|
|||||||
Сильнодіючий |
|
|
|
|
|
|
||||||||
Несильнодіючий |
|
|
|
|
|
|
|
|
|
|
|
Хімічні |
||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лікарські |
|
||||
|
|
|
|
|
|
|
|
|
|
Біологічно активні |
||||
|
|
|
|
|
|
|
|
|
речовини |
|
||||
|
|
|
|
|
|
|
|
|
|
Галенові і ін. |
||||
Формоутворюючі |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Допоміжні |
|
|
Лікарська |
|
|
|
|||||||
Стабілізуючі |
|
|
|
|
|
|
||||||||
|
|
|
рослинна |
|
|
|
||||||||
Пролонгуючі |
|
речовини |
|
|
|
|
|
|||||||
|
|
|
сировина |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
Коригуючі і ін. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Порошки |
|
|
|
|
|
|
|
|
|
|
|
|
Мазі |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Таблетки |
|
|
|
|
Лікарська форма |
|
Розчини |
|||||||
|
|
|
|
|
||||||||||
Гранули |
|
|
|
|
Емульсії |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
Збори |
|
|
|
|
|
|
|
|
|
|
|
Суспензії і ін. |
||
|
|
|
|
|
|
|
|
|
|
|
||||
Пакувальний матеріал |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лікарський препарат
Рис. 1. Взаємозв’язок основних термінів та понять технології ліків
Вентиляційне повітря – повітря з відповідним ступенем очищення, що надходить до приміщення через вентиляційну систему (ГН 4.4.8.073-2001).
Виробнича інструкція – нормативний документ, що має статус стандарту підприємства, який регламентує певну частину виробничого процесу.
Відходи – це модифікований або некондиційний залишок вихідної сировини, матеріалів або напівфабрикатів, що без відповідного перероблення не може бути використаний для виготовлення готового продукту. Відходи, які можуть бути використані повторно для виготовлення готового продукту, називають зворотними. Якщо відходи виробництва мають споживчу цінність і надалі можуть бути перероблені, їх називають побічними продуктами. Відходи виробництва, які не підлягають подальшому переробленню й не становлять споживчої вартості, є браком.
Всмоктування – процес надходження лікарської речовини з місця введення препарату в кров.
Вторинна упаковка – тара, що призначена для захисту первинних упаковок від пошкодження і для докладнішого інформування споживача. Так, останнім часом на вторинних упаковках друкують текст листівки-вкладки про застосування ліків. Вторинна упаковка (картонні або полімерні пачки, коробки) полегшує облік і контроль продукції, а в ряді випадків створює додаткову герметизацію. Вторинна упаковка також є споживчою.
Готовий продукт – кінцевий продукт технологічного процесу, що пройшов одну або кілька стадій оброблення.
Групова упаковка (або блокова) являє собою групу первинних або вторинних упаковок і формується в машинах або автоматах при пакуванні продукції в термоусадочну плівку, папір, картонні коробки.
Державна Фармакопея України – нормативний документ, що містить загальні вимоги до лікарських засобів, методів аналізу, фармакотехнологічних тестів, реактивів, упаковки, маркування, умов зберігання, монографії на субстанції, допоміжні речовини та готові лікарські засоби, а також інформаційні матеріали.
Доклінічне вивчення лікарського засобу – хімічні, фізичні, біологічні, мікробіологічні, фармакологічні, токсикологічні та інші експериментальні наукові дослідження з метою вивчення специфічної дії та безпечності лікарського засобу (Порядок проведення експертизи матеріалів на лікарські засоби…/ Наказ МОЗ України №220 від 19.09.2000).
Допоміжна сировина – сировина, що не входить до складу готового продукту.
Досьє виробничої дільниці (Site Master File) – документ, що підготовлений виробником і містить спеціальну та фактичну інформацію про дотримання вимог GMP при виробництві і (або) контролі фармацевтичної продукції на даній дільниці, а також про будь-які тісно взаємопов’язані роботи в сусідніх спорудах і тих, що примикають (ГНД 09.001 – 98).
Експертиза лікарських засобів (препаратів) – система фармацевтичного, фармакологічного, клінічного і юридичного оцінювання лікарського засобу (препарату) і документації, що його характеризує.
Зазначені вище поняття, що відображають процес перероблення фармацевтичної сировини, використовуються при складанні матеріального балансу.
Звикання – знижена реакція організму на повторне застосування лікарського препарату.
Карантин – статус вихідної сировини, пакувальних матеріалів, проміжної, не розфасованої чи готової продукції, ізольованої фізично або іншими ефективними засобами, поки очікується рішення про видачу дозволу на їхній випуск або відмову в ньому (Настанова 42-01-2001).
Клас чистоти повітря – ступінь чистоти повітря, який визначається кількістю частинок і життєздатних мікроорганізмів в одиниці об’єму повітря.
Клінічні випробування – це встановлення або підтвердження ефективності та безпечності лікарського засобу, яке проводиться у лікувально-профілактичних закладах, уповноважених на це Міністерством охорони здоров’я України за направленням Державного фармакологічного центру.
Контамінація (забруднення) – небажане внесення домішок хімічної і мікробіологічної природи або чужорідних речовин у(на) вихідну сировину, проміжну продукцію чи готову продукцію під час технологічного процесу, відбору проб, пакування або перепакування, зберігання або транспортування.
Листок вкладиш в упаковці – стисла інформація, призначена для пацієнта. Розміщується на паперовому носії і вкладається в упаковку.
Лікарські засоби генерики – лікарські засоби, здатні замінити новий лікарський засіб після закінчення дії патенту (Порядок проведення експертизи матеріалів на лікарські засоби…/ Наказ МОЗ України №220 від 19.09.2000).
Маркування – інформація на первинній та вторинній упаковці. Матеріальний баланс – це співвідношення між кількістю вихідної
сировини й напівфабрикатів і кількістю готового продукту, побічних продуктів, відходів і матеріальних втрат.
Матеріальні втрати утворюються в процесі виробництва внаслідок розпилення, випаровування, налипання матеріалу до стінок апаратури тощо.
Мікробне забруднення – кількість життєздатних мікроорганізмів, які містяться в одиниці об’єму повітря.
Норма витрати – максимально припустима кількість сировини, матеріалів, напівфабрикатів, необхідна для виготовлення одиниці продукції.
Основна сировина – сировина, що входить до складу готового продукту. Первинна упаковка – індивідуальна, або споживча, в якій є безпосередній контакт лікарського засобу з матеріалом упаковки. Вона створює необхідні умови для тривалого захисту лікарської форми. Первинною упаковкою може бути флакон із закупорювальний засобом, ампула, туба з буфоном, контурна
упаковка тощо.
Плацебо – індиферентна у фармакологічному відношенні речовина в лікарському препараті, що імітує лікарський засіб.
Повітряний шлюз – це обмежений простір з двома або декількома дверима між двома або декількома приміщеннями, наприклад різних класів чистоти, який призначений для контрольованого керування потоком повітря між цими приміщеннями при відкриванні дверей. Повітряні шлюзи призначені і використовуються для переміщення персоналу, обладнання і продукції між приміщеннями.
Прекурсори – речовини та їх солі, що використовуються при виробництві наркотичних засобів і психотропних речовин, включених до Переліку (Закон України «Про обіг в Україні наркотичних засобів, психотропних речовин, їх аналогів і прекурсорів»).
Проміжний продукт, або напівфабрикат – продукт, що пройшов одну або кілька стадій оброблення.
Протокол серії – усі документи, які послідовно висвітлюють історію кожної серії готової продукції (виробництво, контроль і реалізацію), а також усі інші обставини, що можуть мати значення для її якості.
Процес – сукупність послідовних дій з метою створення продукту. Реєстраційне посвідчення – документ, який видається замовнику, як
дозвіл для медичного застосування лікарського засобу в Україні.
Серія – визначена кількість вихідної сировини, пакувальних матеріалів або продукції, яка піддається обробленню в одному або в низці послідовних технологічних процесів таким чином, що може розраховувати на однорідність продукції (Настанова 42-01-2001). Серія – конкретна кількість
речовини, отримана внаслідок технологічного процесу або серії процесів таким чином, що можна розраховувати на її однорідність у встановлених межах. У разі безперервного виробництва серія може відповідати певній частині продукції. Розмір серії може визначатися або фіксованою кількістю, або кількістю, виробленою за певний проміжок часу (Настанова 42-02-2002). Серія – визначена кількість готової продукції (лікарського засобу), що одержана в одному технологічному процесі або в ряді послідовних технологічних процесів при обробленні певної кількості вихідної сировини, пакувальних матеріалів або напівпродуктів, яка характеризується однаковими показниками якості (однорідності), закладеними у відповідній нормативній документації.
Сертифікат – письмове свідоцтво (гарантія), що якість ліків (ефективність, безпека) відповідає встановленим вимогам специфікацій, а виробничий процес – правилам GМР належної виробничої практики (НBП).
Сертифікація – процедура, за допомогою якої третя сторона дає письмову гарантію того, що продукція, процес або послуга відповідають заданим вимогам.
Специфікація – якісні і кількісні характеристики лікарського засобу і допустимі межі, яким має відповідати лікарський засіб упродовж встановленого терміну придатності, з посиланнями на методики проведення випробувань.
Стабільність – здатність лікарського засобу (препарату) зберігати свої фізико-хімічні й мікробіологічні властивості впродовж певного часу з моменту його випускання.
Стадія виробництва – сукупність технологічних операцій, що призводить до одержання проміжного продукту-напівфабрикату (на кінцевій стадії – готового продукту), що визначається кількісно й характеризується якісно. Наприклад, процес одержання таблеток включає такі виробничі стадії: змішування, гранулювання, пресування. Кожна стадія, у свою чергу, являє собою сполучення ряду послідовних технологічних операцій.
Строк придатності – затверджений законодавчим органом на підставі результатів спеціальних досліджень час зберігання лікарського засобу (препарату), впродовж якого він зберігає свої фізико-хімічні, мікробіологічні й терапевтичні властивості без змін або у встановлених для них межах за умови дотримання умов зберігання.
Технічні засоби – сукупність знарядь виробництва, необхідних для здійснення технологічного процесу.
Технологічна карта – форма технологічної документації, у якій відбитий весь процес оброблення виробу, зазначені операції та їх складові частини, матеріали, виробниче обладнання й технологічні режими, час, кваліфікація працівників тощо, необхідні для виготовлення продукту (виробу).
Технологічна норма – регламентовані межі технологічно припустимих значень параметра процесу (операції), відхилення за які призводять до зниження якості (браку) продукції.
Технологічна операція – частина технологічного процесу, пов’язана з обслуговуванням одного з основних видів устаткування. Наприклад, у виробництві таблеток такими операціями є подрібнення інгредієнтів, зважування, просівання, зволоження суміші, що підлягає гранулюванню, тощо.
Технологічний метод – сукупність правил, що визначають послідовність і відповідність дій при виготовленні продукту або виробу.
Технологічний процес – частина виробничого процесу, що керується науково обґрунтованим діями, спрямованими на одержання готового продукту. Технологічний процес складається з окремих, логічно побудованих, послідовних стадій виробництва.
Технологічний регламент – нормативний документ, що визначає технологічні методи й технічні засоби, норми й нормативи виробництва лікарського препарату (лікарського засобу або допоміжної речовини), забезпечує оптимум техніко-економічних показників, безпеку проведення робіт і мінімальне забруднення навколишнього середовища.
Технологія – сукупність методів оброблення, виготовлення, зміни стану, властивостей, форми сировини, матеріалу або напівфабрикату, що здійснюються у процесі виробництва продукції. Слово технологія походить з грецької „techne” – майстерність, уміння та „logos” – наука, вчення.
Токсичність – дія лікарського засобу (препарату), що наносить шкоду організму, що може виражатися в розладі фізичної функції або порушенні морфології органів.
Транспортна упаковка – та, в якій продукція доставляється до місць розподілу й реалізації. Вона має бути єдиною для кожної серії лікарського засобу. Це тара, яка є самостійною транспортною одиницею або частиною більшої транспортної одиниці, у якій здійснюється транспортування продукції.
Упаковка – упаковка (первинна та вторинна), в якій лікарський засіб надходить до споживача.
Упаковка «in bulk» – будь-який лікарський засіб, який пройшов усі стадії виробництва, за винятком остаточного пакування.
Фармакокінетика – опис змін у часі концентрацій введеного лікарського засобу і його метаболітів в організмі; охоплює такі транспортні процеси діючої речовини і його метаболітів в організмі, як всмоктування, розподіл, біотрансформація й елімінація.
Чиста зона – зона, в якій контролюється навколишнє середовище на наявність частинок і мікроорганізмів (контамінантів), побудована і експлуатується таким чином, щоб зменшити проникнення, утворення і зберігання контамінантів усередині зони.
Чиста кімната (приміщення) – приміщення, в якому контролюється концентрація частинок і яке має одну або декілька «чистих» зон.
Якість лікарського препарату – сукупність властивостей, які надають лікарському препарату здатність задовольняти потреби споживачів відповідно до свого призначення, що забезпечується дотриманням вимог технологічної нормативної документації при виробництві лікарського засобу та
підтверджується відповідністю лікарського засобу вимогам аналітичного нормативного документу.
Фармацевтична термінологія, що поєднує терміни цілої галузі, повинна включати терміни всіх напрямків фармацевтичної технології: керування й фармацевтичного маркетингу, пошуку, вивчення й дослідження ліків, їх виробництва, контролю якості тощо, тому що терміни цих напрямків галузі взаємно проникають один в один. Такий взаємозв’язок повинен спостерігатися з технічними, хімічними, медичними й іншими термінами, які широко й постійно використовуються при описанні технологічних процесів, вивченні фізико-хімічних властивостей лікарських препаратів, прийнятті законодавчих актів тощо.
Нормативно-технічна документація у промисловому виробництві ліків
Промислове виробництво ліків регламентується відповідною
нормативно-технічною документацією (НТД), затвердженої у встановленому порядку. НТД повинна забезпечувати підвищення якості й ефективності лікарських препаратів, постійно вдосконалюватися на основі досягнень науки й техніки й вчасно переглядатися з метою заміни застарілих показників відповідно до потреб охорони здоров’я населення, безпеки країни й експорту.
В Україні існують однакові вимоги до змісту, порядку розроблення, узгодження й затвердження НТД хіміко-фармацевтичної продукції медичного призначення, а також продукції ветеринарного призначення й харчових добавок, вироблених хіміко-фармацевтичними підприємствами й фармацевтичними фабриками.
Нормативна документація – це документи, що встановлюють правила, загальні принципи або характеристики стосовно різних видів діяльності або їх результатів.
НТД на лікарські препарати, лікарську рослинну сировину й вироби медичної техніки поділяються на наступні категорії:
1.Технологічні й технічні регламенти.
2.Державна фармакопея України (ДФУ).
3.Аналітично нормативна документація (АНД), фармакопейні статті
(ФС).
4.Державні стандарти (ГОСТ, ДСТУ).
5.Галузеві стандарти (ОСТ), Галузевий стандарт України (ГСТУ).
6.Технічні умови (ТУ).
7.Керівний нормативний документ (КД) – інструкції, методичні вказівки тощо.
8.Виробничі й технологічні інструкції.
Державна Фармакопея України – нормативний документ, що містить загальні вимоги до лікарських засобів, методів аналізу, фармакотехнологічних тестів, реактивів, упаковки, маркування, умов зберігання, монографії на субстанції, допоміжні речовини та готові лікарські засоби, а також інформаційні
матеріали. Фармакопейні статті на препарати, що мають найбільшу терапевтичну цінність, які широко ввійшли в медичну практику і мають високі якісні показники включаються в Державну Фармакопею України (ДФУ). Крім фармакопейних статей на лікарські препарати, ДФУ містить загальні методи фізико-хімічного, хімічного й біологічного аналізу й відомості про застосовувані реактиви, індикатори, а також інші матеріали, що містять загальні вимоги й норми до лікарських препаратів. ДФУ є збірником обов’язкових загальнодержавних стандартів і положень, що нормують якість ліків.
Аналітичний нормативний документ (АНД) – нормативний документ, що визначає якісні і кількісні показники лікарського засобу, їх допустимі межі та методики проведення випробувань, встановлює вимоги до упаковки, маркування, умов зберігання, транспортування, терміну придатності лікарського препарату. АНД є невід’ємною частиною реєстраційних документів – комплекту матеріалів на лікарський засіб, спеціалізована оцінка яких надає змогу зробити висновки про можливість його державної реєстрації, потребу проведення передреєстраційних досліджень або контролю якості зразків лікарського засобу.
Проведення експертизи та затвердження АНД регламентує Постанова Кабінету Міністрів України від 13 вересня 2000 року за №1422 «Порядок державної реєстрації (перереєстрації) лікарського засобу».
АНД повинна містити такі відомості:
-склад препарату із зазначенням точної кількості усіх інгредієнтів на одиницю лікарського засобу з посиланням на монографії з фармакопей, яким вони відповідають за якістю;
-специфікацію у вигляді таблиці, в якій у першій колонці перераховані усі показники якості препарату, у другій – наведена регламентація за цими показниками, а в третій колонці вказано посилання на методи контролю за цими показниками;
-методики контролю якості препарату фірми-виробника згідно порядку, наведеному в специфікації;
-упаковку, маркування, транспортування, зберігання, термін придатності.
Вкінці АНД наводять відомості про основну фармакологічну дію лікарського засобу. Затверджується АНД Наказом Міністерства охорони здоров’я України із зазначенням номера реєстраційного посвідчення лікарського засобу і підписується директором Фармакологічного центру МОЗ України.
На підставі рішення про державну реєстрацію лікарський засіб вноситься до Державного реєстру лікарських засобів, що ведеться Міністерством охорони здоров’я України. Матеріали щодо методів контролю (АНД) за якістю лікарського засобу надсилаються до Державного департаменту з контролю за якістю, безпекою та виробництвом лікарських засобів і виробів медичного призначення та Державної інспекції з контролю за якістю лікарських засобів. Чинність АНД (в часі) визначається терміном дії реєстраційного посвідчення на лікарський засіб.
Стандарт – нормативний документ, у якому встановлені для загального й багаторазового використання правила, вимоги, загальні
принципи або характеристики, що стосуються різних видів діяльності або їх результатів для досягнення оптимального ступеня впорядкування у певній галузі.
Державний і галузевий стандарти (ДСТУ, ГОСТ) встановлюються на додаткові технічні вимоги й групові характеристики, необхідні для виготовлення й імпорту лікарських препаратів (технічні терміни й позначення, технічна документація, технологічні норми тощо). ГОСТи затверджуються Міністерством охорони здоров’я України або Міністерством медичної й мікробіологічної промисловості України за узгодженням із МОЗ України.
Деякі види сировини, допоміжні речовини, тара й упаковка нормуються технічними умовами (ТУ) або тимчасовими технічними умовами (ТТ У).
Технічні умови – нормативний документ , що встановлює вимоги до конкретної продукції, послуг і регулює відносини між постачальником і споживачем продукції.
Вся робота фармацевтичних підприємств характеризується суворою регламентацією й плануванням виробництва. Технологічний процес виробництва лікарських препаратів здійснюється на підставі нормативно-технічної документації, представленої у вигляді двох
регламентів – технологічного, що стосується виробництва конкретного найменування продукції, і технічного, що містить вимоги до комплексу обладнання і його безпечної експлуатації на даній виробничій ділянці в даному цеху.
Технологічний регламент – це нормативний документ, у якому викладені технологічні методи, технічні засоби, норми й нормативи виготовлення лікарського засобу.
Вимоги даних регламентів гарантують якість продукції, що випускається, раціональне безпечне проведення технічних процесів, збереження обладнання, виключення можливості виникнення аварій і забруднення навколишнього середовища.
Таким чином, дія технологічного регламенту поширюється на виробництво конкретного лікарського препарату за умови наявності технічного регламенту.
Дія технічного регламенту охоплює підготовку виробничих (лабораторних, дослідно-промислових і промислових) приміщень і персоналу до роботи; створення необхідних санітарно-гігієнічних умов виробництва; виконання вимог, пов’язаних з охороною праці, технікою безпеки, пожежною безпекою, охороною навколишнього середовища; кваліфіковану ефективну експлуатацію обладнання, що гарантує
одержання лікарських засобів відповідно до вимог НТД. |
|
|||||
Регламент |
виробництва |
хіміко-фармацевтичної |
продукції |
|||
використовують як основний технологічний документ при: |
|
|||||
|
напрацюванні |
розроблюваної |
хіміко-фармацевтичної |
|||
продукції |
для |
доклінічного |
й |
клінічного вивчення й введення нової |
||
