
- •§ 1. Природные носители
- •§ 2. Синтетические полимерные носители
- •§ 5. Природные носители (липиды)
- •§ 7. Макропористые кремнеземы
- •§ 8. Другие неорганические носители
- •§ 1. Носители для адсорбционной иммобилизации
- •2. Методика адсорбционной |м мобилизации
- •§ 3. Природа адсорбционных взаимодействий фермента с носителем
- •§ 5. Способы увеличения эффективности связывания фермента с носителем
- •§ 6. Преимущества и недостатки адсорбционной иммобилизации
- •§ 7. Иммобилизация ферментов в гелях, полученных полимеризацией мономеров
- •§ 8. Иммобилизация ферментов в гелях, полученных из готовых полимеров
- •§ 9. Влияние различных факторов
- •§10. Преимущества и недостатки иммобилизации ферментов путем включения в гель
- •§ 11. Микрокапсулирование
- •§ 12. Двойное эмульгирование
- •§ 13. Включение в волокна
- •§ 14. Включение в лилосомы
- •§ 15. Преимущества и недостатки иммобилизации с использованием полупроницаемых оболочек
- •§ 16. Двухфазные системы типа
- •§ 17. Микромульемм
- •§ 1. Основные принципы конструирования препаратов ковалентно иммобилизованных ферментов
- •§ 2. Химическая структура ферментов и их функциональные группы
- •§ 3. Приемы химической (ковалентнон) им мобилизации белков
- •§ 4. Недостатки и преимущества получения
- •§ 1. Кинетические параметры ферментативных реакций
- •§ 2. Влияние иммобилизации на состояние фермента
- •§ 3. Эффекты распредепения реагентов в катализе иммобилизованными ферментами
- •2 Cosh of -- I
- •1. Распределение протонов- в качестве примера рассмотрим
- •§ 1. Воздействия и вещества, вызывающие инактивацию ферментов
- •§ 2. Молекулярные механизмы инактивации ферментов
- •Лиэинояланин
- •Op нйтиноаланн н
- •§ 3. Влияние иммобилизации на инактивацию ферментов
- •§ 4. Подавление с помощью иммобилизации первичных обратимых стадий денатурации и диссоциации матнвных белков
- •§ 5. Пучи стабилизации ферментов,
- •§ 1. Реактивация инактивированных ферментов
- •§ 2. Регенерация кофакторов (коферментов}
- •V фермент б /
- •37, 41. 42, 44, 47, 79, 80 Фосфорилирование 124, 127
§ 9. Влияние различных факторов
на каталитическую активность ферментов, иммобилизованных
путем включения в гель
Содержание фермента в геле. Каталитическая активность иммобилизованного препарата возрастает с увеличением количества включенного фермента. Такого увеличения можно добиться, очевидно, повышая концентрацию фермента а исходной смеси, используемой дли приготовления геля. Следует, однако, иметь в виду, что растворимость белков в гелеобразующих системах может быть существенно ниже растворимости в водном буферном растворе.
62
Другой важный фактор, определяющий содержание фермента в геле,, — это структура самого геля, точнее^ размер имеющихся в нем пор. Чем меньше диаметр пор, тем более эффективно фермент удерживается в матрице геля, а значит, тем выше будет каталитическая активность иммобилизованного препарата. Пористость геля можно регулировать, изменяя состав исходной смеси для его получения. Например, плотность гелей, получаемых полимеризацией производных акриловой кислоты, возрастает с увеличением исходной концентрации мономера. (Следует помнить, однако, что слишком высокая концентрация мономера может вызывать денатурацию фермента, поэтому зависимость удельной каталитической активности иммобилизованного препарата от исходной концентрации мономера часто проходит через максимум, который обычно лежит в интервале концентраций мономера 30—60%.) Размер пор сильно зависит также от концентрации добавляемого в раствор мономера сшивающего агента, В случае акриловых полимеров эта зависимость имеет вид кривой с минимумом при концентрации сшивки около 5%. При этой же концентрации сшивки достигается максимальная активность включенного фермента.
Эффективность включения повышается не только при уменьшении диаметра пор геля, но и при увеличении размеров ферментной глобулы. Поэтому для предотвращения вымывания из геля ферменты с небольшой молекулярной массой иногда перед проведением иммобилизации подвергают обработке глутаровым альдегидом, в результате которой получаются крупные ковалентно сшитые белковые агрегаты, прочно удерживаемые полимерной матрицей.
размеры геле вы х частиц. Увеличение концентрации фермента в геле* не всегда приводит к соответствующему повышению каталитической активности иммобилизованного препарата. Дело в том, что при высокой концентрации фермента весь субстрат перерабатывается уже в поверхностном слое геле вой частицы, не достигая молекул фермента, расположенных в ее глубине. В результате каталитический потенциал системы используется не полностью и общая наблюдаемая удельная активность фермента снижается. (Более подробное обсуждение этого вопроса см, в гл. IV.) Очевидно, что влияние этого неблагоприятного эффекта можно ослабить, если использовать мелкоизмельченный препарат иммобилизованного в геле фермента. Действительно, скорость реакции, катализируемой 0-галактозидазой, иммобилизованной в геле поли-оксйэтилметакрилата, возрастает при измельчении геля и достигает максимального значения при уменьшении диаметра гелееых частиц до 120 мкм, оставаясь затем неизменной. Рассмотрим некоторые способы получения иммобилизованных в геле ферментов в форме мелких частиц.
Наиболее простой метод заключается в механическом измельчении блока полимерного геля путем растирания, продавливання через мелкое сито, а также гомогенизации (рис. 8,а). Этот метод»
63
галевыи
диаметр частиц 1-Ю00 мкм
эмульсия водй/насло


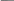
удаление ПАВ
6
 овращвннап
мицелла
овращвннап
мицелла
Средний диаметр частиц 001
мнм
вода/масло
Рис. 8. Способы получения иммобилизованных в геле ферментов
в форме мелкнх частиц
однако, имеет ряд существенных недостатков. Получаемые частицы обладают низкой механической прочностью, являются крайне неоднородными по форме и размерам. Кроме того, молекулы фермента, оказавшиеся при измельчении геля на поверхности частиц, легко с нее смываются, что приводит к потерям биокатализатора. Перечисленные недостатки в значительной степени удается
64
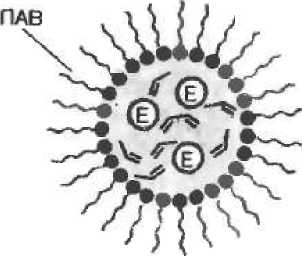
преодолеть при использовании эмульсионного способа получения гелевых частиц (рис. 8,6). В этом случае водный раствор, содержащий фермент, мономер и инициатор полимеризации, немедленно после приготовления вносят в неполярный органический растворитель (например, смесь толуола с хлороформом), содержащий поверхностно-активное вещество (ПАВ), и полученную смесь интенсивно перемешивают. В результате образуется эмульсия, состоящая из диспергированных в органической среде капель водного полимеризующегося раствора, стабилизированных ПАВ. После окончания полимеризации полученные частицы геля сферической формы отфильтровывают и отмывают водой от непрореаги-ровавшего мономера и ПАВ. В зависимости от условий проведения процесса (концентрация мономера» скорость перемешивания и т. д.) размер получаемых частиц колеблется от нескольких единиц до сотен микрометров. Одно из преимуществ эмульсионного способа состоит в том, что благодаря интенсивному тепло-переносу в мелкодисперсной системе устраняется опасность инактивации фермента под действием теплоты, выделяющейся при полимеризации. Сферические геле вые частицы характеризуются узким распределением по размерам (отклонение от среднего диаметра составляет ±10%) и высокой механической прочностью, которая может быть в 10 раз выше, чем в случае частиц, полученных путем механического измельчения гелевого блока. При использовании эмульсионного способа необходимо иметь в виду, что некоторые ПАВ, применяемые для получения стабильных эмульсий, могут вызывать денатурацию фермента.
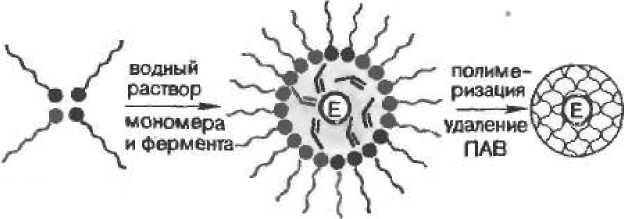
Полимерные частицы геля еще более мелких размеров (нано-частицы), могут быть изготовлены путем полимеризации в так называемых микроэмульсиях (рис- 6,8). Здесь используется свойство некоторых ПАВ образовывать в неполярных органических растворителях обращенные мицеллы, способные солюбилнзовать (растворять) водные растворы мономера и фермента. В результате солюбилизации формируется микроэмульсия, состоящая из мельчайших капелек водного раствора, стабилизированных ПАВ. Размер этих капелек и, соответственно, размер наночастиц, образующихся в процессе полимеризации, инициируемой облучением ультрафиолетовым светом, изменяется в зависимости от количества добавленной воды в пределах от нескольких единиц до нескольких десятков нанометров. Полученные наночастицы осаждают из органического растворителя ацетоном, отделяют центрифугированием и высушивают.
Однако применение в технологических реакторах мелких частиц иммобилизованного биокатализатора не всегда рационально. Например, излишне мелкие частицы оказывают сильное гидродинамическое сопротивление потоку при эксплуатации реакторов проточного типа, а в реакторах периодического действия их трудно отделить от реакционной смеси. Поэтому в каждом конкретном случае оптимальный размер частиц определяется с учетом таких
65
факторов, как количество и активность включенного фермента» скорость диффузии субстрата в геле и конструкция реактора.
С практической точки зрения удобен метод так называемой двойной иммобилизации, при котором в гель включается фермент, предварительно иммобилизованный путем адсорбции на твердом носителе, или же получение полимерного геля с включением фермента проводится в присутствии такого носителя. Приготовленный таким образом иммобилизованный препарат состоит из частиц твердого носителя, покрытых слоем ферментсодержащего гелн-Метод двойной иммобилизации сочетает преимущества твердой матрицы (большая удельная поверхность, механическая прочность, пористость, заданная текстура и форма частиц) и полимерных гелей.
Природа полимерной матрицы. Полимерные гели, применяемые для иммобилизации, способствуют созданию оптимального микроокружения включенного фермента, что позволяет добиться высокой каталитической активности иммобилизованных препаратов. Оптимизация микроокружения достигается за счет подбора соответствующей гелеобразующей системы. Особенно удобными с этой точки зрения являются гели на основе сополимеров производных акриловой кислоты. Варьируя химическую природу исходных мономеров и их соотношение, можно получать полимерные матрицы с наиболее подходящими для данной ферментативной реакции характеристиками. В частности, при введении в состав полимера мономерных звеньев, несущих электрический заряд, повышается каталитическая эффективность иммобилизованного препарата в реакциях с участием наряженных субстратов. Например, скорость реакции гидролиза положительно заряженного субстрата этилового эфира a-N-бен-зоил-L-аргинина под действием трипсина, иммобилизованного в геле полиакриламида, возрастает при введении в полимерную цепь путем со поли мери заики отрицательно заряженных мономерных звеньев акриловой кислоты. Увеличение скорости ферментативной реакции объясняется повышенным сродством положительно заряженного субстрата к отрицательно заряженной полимерной матрице.
Аналогичный эффект влияния полимерной матрицы на распределение субстрата между гелем и окружающим его раствором наблюдается также в реакциях с участием гидрофобных субстратов. В этом случае увеличение каталитической эффективности иммобилизованного фермента достигается при использовании геля, полученного путем сополимеризации с участием неполярных мономеров. Более того, применение гелей на осноне полимеров, обладающих высокой гидрофобностью, позволяет получать иммобилизованные ферментные препараты, способные работать в среде неполярных органических растворителей.
Введение в полимерные цепи геля ионных групп создает вокруг включенных молекул фермента среду, обладающую буферными свойствами. В результате значение рН, при котором
66
функционирует иммобилизованный фермент, может отличаться от рН окружающего частицу геля раствора, что на опыте проявляется в виде сдвига наблюдаемого рН-оптимум а ферментативной реакции. Таким образом, варьируя содержание в геле заряженных групп, можно создать вблизи, фермента наиболее благоприятное для него значение рН, не меняя рН внешнего раствора.
Более подробно эффекты микросреды (влияние заряда, гидрофобности носителя и т. п.) в катализе иммобилизованными ферментами рассмотрены в гл. IV.
